题目内容
11.玻璃器皿上沾有一些用水洗不掉的残留物,其洗涤方法正确的是( )①用酒精洗涤试管内壁上残留的碘②用热碱液洗涤试管内壁上的油脂③用稀氨水洗涤试管壁上银镜④用酒精洗涤试剂瓶中残留的苯酚.
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
分析 ①碘易溶于酒精;
②氢氧化钠能和油脂反应;
③银单质与氨水不反应;
④苯酚易溶于酒精;
解答 解:①根据碘溶于酒精的性质,所以可用酒精清洗残留碘的试管,故①正确;
②氢氧化钠能和油脂反应,从而把油脂除去,故②正确.
③银单质与氨水不反应,可用稀硝酸洗去,故③错误;
④苯酚易溶于酒精,残留有苯酚的试管,可用酒精洗涤,故④正确;
故选A.
点评 本题主要考查化学实验基本操作,主要是常见物质的溶解度考查,难度不大,注意基础知识的积累.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
2.若NA表示阿伏加德罗常数,下列说法中,正确的是( )
| A. | 1 mol Cl2作为氧化剂得到的电子数为NA | |
| B. | 在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3 NA | |
| D. | 将0.1mol FeCl3加到沸水中制得的胶体中,含胶粒0.1NA |
19.人们常将在同一原子轨道上运动的、自旋状态相反的2个电子,称为“电子对”;在同一原子轨道上运动的单个电子,称为“未成对电子”.以下有关主族元素原子的“未成对电子”的说法,错误的是( )
| A. | 第四周期元素的基态原子中,Cr元素的未成对电子数最多 | |
| B. | 第三周期元素中3p原子轨道有一个未成对电子的原子有2种 | |
| C. | 核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子” | |
| D. | 基态碳原子无未成对电子 |
6.下列盐,既可以用“碱性氧化物+酸”制取,也可以用“酸性氧化物+碱”制取的是( )
| A. | KCl | B. | Na2S | C. | (NH4)2SO4 | D. | BaSO4 |
16.下列有关实验操作分析正确的是( )
| A. | 从溴水中萃取溴,可用酒精做萃取剂 | |
| B. | 蒸发实验完毕后,发现蒸发皿炸裂,这是因为没有垫石棉网 | |
| C. | 萃取碘水溶液中碘,分离碘四氯化碳溶液时,眼睛注视分液漏斗里液面 | |
| D. | 蒸馏时,为了加快水的流速,水应从上口进入,下口流出 |
6.某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性.
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片.
实验记录:
实验结论:Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性.
(2)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:AEF.(填序号)
A.Cl2 B.Na C.Na+ D.Cl- E.SO2 F.NO2
(3)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时可以在溶液中加入少量铁粉以防止亚铁盐被氧化.
(4)检验亚铁盐溶液是否被氧化的操作步骤和现象是取少许亚铁盐溶液于试管中,滴加几滴KSCN溶液,如果溶液变红则说明亚铁盐被氧化.
(5)向FeCl2溶液滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为生成白色沉淀,迅速变成灰绿色,最终变成红褐色,此过程中发生的氧化还原反应的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(1)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性.
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片.
实验记录:
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 | (不写) | Zn+Fe2+═Zn2++Fe | |
| ③ | 在FeCl3溶液中加入足量铁粉 | Fe+2Fe3+═3Fe2+ | Fe3+具有氧化性 | |
| ④ | (不写) | Fe3+具有氧化性 |
(2)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:AEF.(填序号)
A.Cl2 B.Na C.Na+ D.Cl- E.SO2 F.NO2
(3)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时可以在溶液中加入少量铁粉以防止亚铁盐被氧化.
(4)检验亚铁盐溶液是否被氧化的操作步骤和现象是取少许亚铁盐溶液于试管中,滴加几滴KSCN溶液,如果溶液变红则说明亚铁盐被氧化.
(5)向FeCl2溶液滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为生成白色沉淀,迅速变成灰绿色,最终变成红褐色,此过程中发生的氧化还原反应的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
3.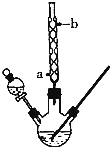 某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:
某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:
(1)该实验中,将乙醇、乙酸和浓硫酸加入三颈烧瓶中时,最先加入的液体不能是浓硫酸.
(2)水从冷凝管的a(填“a”或“b”)处进入.
(3)已知下列数据:
又知温度高于140℃时发生副反应:2CH3CH2OH→CH3CH2OCH2CH3+H2O.
①该副反应属于b反应(填字母).
a.加成 b.取代 c.酯化
②考虑到反应速率等多种因素,用上述装置制备乙酸乙酯时,反应的最佳温度范围是c(填字母).
a.T<77.5℃b.T>150℃c.115℃<T<130℃
(4)将反应后的混合液缓缓倒入盛有足量饱和碳酸钠溶液的烧杯中,搅拌、静置.饱和碳酸钠溶液的作用是中和乙酸、溶解乙醇,降低乙酸乙酯的溶解度,便于分层欲分离出乙酸乙酯,应使用的分离方法是分液(填操作方法名称,下同),所用到的仪器为分液漏斗,乙酸乙酯从该仪器的上端(上端或下端)流出.进行此步操作后,所得有机层中的主要无机物杂质是水,在不允许使用干燥剂的条件下,除去水可用蒸馏的方法.
(5)若实验所用乙酸质量为6.0g,乙醇质量为5.0g,得到纯净的产品质量为4.4g,则乙酸乙酯的产率是50%.
 某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:
某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:(1)该实验中,将乙醇、乙酸和浓硫酸加入三颈烧瓶中时,最先加入的液体不能是浓硫酸.
(2)水从冷凝管的a(填“a”或“b”)处进入.
(3)已知下列数据:
| 乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
| 熔点/℃ | -117.3 | 16.6 | -83.6 | - |
| 沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
①该副反应属于b反应(填字母).
a.加成 b.取代 c.酯化
②考虑到反应速率等多种因素,用上述装置制备乙酸乙酯时,反应的最佳温度范围是c(填字母).
a.T<77.5℃b.T>150℃c.115℃<T<130℃
(4)将反应后的混合液缓缓倒入盛有足量饱和碳酸钠溶液的烧杯中,搅拌、静置.饱和碳酸钠溶液的作用是中和乙酸、溶解乙醇,降低乙酸乙酯的溶解度,便于分层欲分离出乙酸乙酯,应使用的分离方法是分液(填操作方法名称,下同),所用到的仪器为分液漏斗,乙酸乙酯从该仪器的上端(上端或下端)流出.进行此步操作后,所得有机层中的主要无机物杂质是水,在不允许使用干燥剂的条件下,除去水可用蒸馏的方法.
(5)若实验所用乙酸质量为6.0g,乙醇质量为5.0g,得到纯净的产品质量为4.4g,则乙酸乙酯的产率是50%.
4. 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为MnSO4.
(2)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g) 分子中化学键断裂时需吸收的能量为299kJ.
(3)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)
716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
①根据上述实验结果,该反应的平衡常数K的表达式为:$\frac{0.108×0.108}{0.78{4}^{2}}$.
②上述反应中,正反应速率为v正=k正•x2(HI),逆反应速率为v逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{k}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1
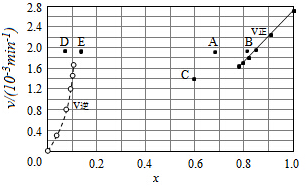
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母)
 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为MnSO4.
(2)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g) 分子中化学键断裂时需吸收的能量为299kJ.
(3)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)
716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为v正=k正•x2(HI),逆反应速率为v逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{k}_{正}}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母)