题目内容
11.在某一容积为2L的密闭容器内,加入0.2mol的CO和 0.2mol的 H2O(g),在催化剂存在的条件下恒温下发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=a kJ/mol(a>0).反应达到平衡后,测得c(CO):c(CO2)=3:2.下列说法正确的是( )| A. | 当体系压强不变时反应一定达到平衡 | |
| B. | 反应放出的热量为 0.2a kJ | |
| C. | 若升高温度,v(正)加快,v(逆)减慢,平衡正向移动 | |
| D. | 在相同条件下再加入0.2mol的CO和0.2mol的 H2O(g),重新达平衡时,c(CO):c(CO2)=3:2 |
分析 A.该反应为反应前后气体物质的量不变的反应;
B.0.2molCO不能完全反应;
C.升高温度,正逆反应速率均增大,向吸热的方向移动;
D.容积为2L的密闭容器内,再加入0.2mol的CO和0.2mol的 H2O(g),压强增大,平衡不移动.
解答 解:A.该反应为反应前后气体物质的量不变的反应,则当体系压强不变时,不能判定平衡,故A错误;
B.0.2molCO不能完全反应,则反应放出的热量小于 0.2a kJ,故B错误;
C.升高温度,正逆反应速率均增大,向吸热的方向移动,则v(正)、v(逆)均加快,平衡正向移动,故C错误;
D.容积为2L的密闭容器内,再加入0.2mol的CO和0.2mol的 H2O(g),压强增大,平衡不移动,重新达平衡时,c(CO):c(CO2)=3:2,故D正确;
故选D.
点评 本题考查化学平衡移动,为高频考点,把握平衡的判断、平衡移动、热化学方程式的意义为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
19.某浓度的氨水中存在下列平衡:NH3•H2O?NH${\;}_{4}^{+}$+OH-,如果增大NH${\;}_{4}^{+}$的浓度,而不增大OH-的浓度,应采取的措施是( )
| A. | 加入氯化铵固体 | B. | 适当升高温度 | C. | 通入氨气 | D. | 加入少量浓盐酸 |
3.一定温度下,将0.1molAgCl加入1L 0.1mol•L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是( )
| A. | 沉淀转化反应2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol•L-1 | |
| B. | 约有2×10-5mol AgCl溶解 | |
| C. | 反应后溶液中的:c(Na+)>c (Cl-)>c (CO32-)>c (OH-)>c (H+) | |
| D. | 反应后溶液中的:c(Na+)+c (H+)+c (Ag+)=2 c (CO32-)+c (HCO3-)+c (Cl-)+c (OH-) |
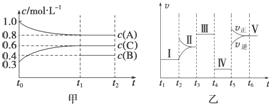 向某密闭容器中加入 4mol A、1.2mol C 和一定量的 B 三种气体,一定条件 下发生反应,各物质的浓度随时间变化如甲图所示[已知 t0~t1 阶段保持恒温、恒容,且 c(B)未画出].乙图为 t2 时刻后改变反应条件,反应速率随时间的变化情况,已知 在 t2、t3、t4、t5 时刻各改变一种不同的条件,其中 t3 时刻为使用催化剂.
向某密闭容器中加入 4mol A、1.2mol C 和一定量的 B 三种气体,一定条件 下发生反应,各物质的浓度随时间变化如甲图所示[已知 t0~t1 阶段保持恒温、恒容,且 c(B)未画出].乙图为 t2 时刻后改变反应条件,反应速率随时间的变化情况,已知 在 t2、t3、t4、t5 时刻各改变一种不同的条件,其中 t3 时刻为使用催化剂.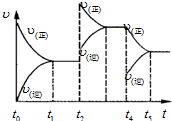 工业上生产硝酸的主要过程如下:
工业上生产硝酸的主要过程如下: