题目内容
16.200mL 2mol/L的Al2(SO4)3溶液中SO42-的物质的量浓度为6 mol/L.分析 硫酸铝完全电离,硫酸根浓度为硫酸铝的3倍,据此计算.
解答 解:硫酸铝完全电离,硫酸根浓度为硫酸铝的3倍,SO42-的物质的量浓度为2mol/L×3=6mol/L;
故答案为:6.
点评 本题考查物质的量浓度有关计算,比较基础,注意理解电解质离子浓度与电解质浓度关系,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
7.Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”.S2O32-和Cl2反应的产物之一为SO42-.下列说法不正确的是( )
| A. | 该反应中的还原剂是S2O32- | |
| B. | 该反应的氧化产物是Cl- | |
| C. | 上述反应中,每生成1 mol SO42-,可脱去2 mol Cl2 | |
| D. | 根据该反应可判断氧化性:Cl2>SO42- |
4.下列有关热化学方程式的叙述正确的是( )
| A. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ | |
| B. | 已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷稳定 | |
| C. | 含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-57.4kJ/mol | |
| D. | 己知C(s)+O2 (g)=CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2 则△H1>△H2 |
8.下列物质中,能够导电的电解质是( )
| A. | 铜丝 | B. | 熔融的MgCl2 | C. | NaCl溶液 | D. | SO3 |
6.下列盐,既可以用“碱性氧化物+酸”制取,也可以用“酸性氧化物+碱”制取的是( )
| A. | KCl | B. | Na2S | C. | (NH4)2SO4 | D. | BaSO4 |
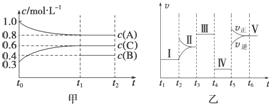 向某密闭容器中加入 4mol A、1.2mol C 和一定量的 B 三种气体,一定条件 下发生反应,各物质的浓度随时间变化如甲图所示[已知 t0~t1 阶段保持恒温、恒容,且 c(B)未画出].乙图为 t2 时刻后改变反应条件,反应速率随时间的变化情况,已知 在 t2、t3、t4、t5 时刻各改变一种不同的条件,其中 t3 时刻为使用催化剂.
向某密闭容器中加入 4mol A、1.2mol C 和一定量的 B 三种气体,一定条件 下发生反应,各物质的浓度随时间变化如甲图所示[已知 t0~t1 阶段保持恒温、恒容,且 c(B)未画出].乙图为 t2 时刻后改变反应条件,反应速率随时间的变化情况,已知 在 t2、t3、t4、t5 时刻各改变一种不同的条件,其中 t3 时刻为使用催化剂.