题目内容
3.CuO、Fe铁粉、Fe3O4混合物中,加一定量稀H2SO4并微热,当反应停止后,滤出不溶物,并向溶液中插入一枚铁钉,片刻后取出铁钉,发现铁钉并无变化,根据上述现象,确定下面结论中正确的是( )| A. | 稀硫酸可能过量 | |
| B. | 不溶物中一定含有Fe | |
| C. | 不溶物中一定含有 Cu,但不一定含有Fe | |
| D. | 滤液中一定含有Fe(SO4)3,但不一定含有FeSO4 |
分析 向滤液中插入一枚铁钉,发现铁钉无任何变化,可判断滤中不含硫酸和硫酸铜,因此所加入的稀硫酸可能恰好完全反应也可能量不足;根据金属的活动性铁>氢>铜,铁粉能把氧化铜与硫酸反应生成硫酸铜中的铜置换出来,铜不能与硫酸反应,因此不溶物一定含有Cu,以此来解答.
解答 解:向滤液中插入一枚铁钉,发现铁钉无任何变化,可判断滤中不含硫酸和硫酸铜,因此所加入的稀硫酸可能恰好完全反应也可能量不足;根据金属的活动性铁>氢>铜,铁粉能把氧化铜与硫酸反应生成硫酸铜中的铜置换出来,铜不能与硫酸反应,因此不溶物一定含有Cu,
A.根据分析可知,加入的稀硫酸可能不足,也可能恰好反应,不会有剩余,故A错误;
B.在实验过程中,铁粉可能完全反应也可能有剩余,所以不溶物中不一定含铁,故B错误;
C.由于不能确定所加入稀硫酸的量,则固体中一定含有铜,铁不一定有剩余,故C正确;
D.反应后一定有铜析出,铁离子与铜能够反应,所以滤液中一定不存在硫酸铁,故D错误;
故选C.
点评 本题考查铁的化学性质及混合物反应的计算,为高频考点,明确发生反应的实质为解答关键,试题侧重考查学生的分析、理解能力及逻辑推理能力,题目难度中等.

练习册系列答案
相关题目
11.下列有关说法正确的是( )
| A. | 化学反应的平衡常数越大,反应进行的速率越快 | |
| B. | 加热、蒸干NaAlO2溶液和AlCl3溶液,并灼烧都得到Al2O3 | |
| C. | CH3COOH 溶液加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变 | |
| D. | 0.1mol•L-1CH3COONa溶液中加入少量固体NaOH,碱性增强,平衡向水解方向移动 |
18.A、B、C、D、E是原子序数依次增大的前四周期的常见元素.已知:
(1)写出E原子基态核外电子排布式1s22s22p63s23p63d104s1.比较B、C、D电负性的大小顺序C<N<O.(按由小到大)
(2)与C2互为等电子体的分子有CO,离子有CN-或C22-.
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图1),画出其中E2+离子与N、O原子间的化学键.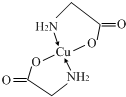 .
.
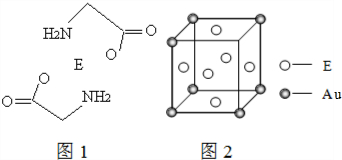
(4)E和金(Au)形成的合金的晶胞结构如图2,则该合金的化学式可表示为Cu3Au.
| A | 原子半径最小 |
| B | 核外3个能级上的电子数相等 |
| C | 其氢化物的沸点比同族相邻周期元素氢化物的沸点高 |
| D | 2p轨道上成对电子数与未成对电子数相等 |
| E | N层电子数为1,内层轨道全部排满电子 |
(2)与C2互为等电子体的分子有CO,离子有CN-或C22-.
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图1),画出其中E2+离子与N、O原子间的化学键.
 .
.(4)E和金(Au)形成的合金的晶胞结构如图2,则该合金的化学式可表示为Cu3Au.

15.在电解质溶液中,一定相等的是( )
| A. | 阴离子数和阳离子数 | |
| B. | 阳离子的正电荷总数和阴离子的负电荷总数 | |
| C. | 阴、阳离子的质量 | |
| D. | 每个阳离子与每个阴离子所带的电荷 |
13.下列关于(强、弱)电解质和非电解质的叙述中,错误的是( )
| A. | 酸、碱、盐都是电解质 | |
| B. | 蔗糖、酒精是非电解质 | |
| C. | 盐酸是强电解质 | |
| D. | NH3的水溶液能导电,但NH3不是电解质 |
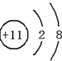 .
.