题目内容
13.某化合物A的焰色反应为黄色,在其溶液中滴加氯水和少许CCl4,振荡后,下层变成紫色.继续滴加氯水,振荡后,下层会逐渐变浅,最后紫色褪去.(1)A中金属阳离子的结构示意图为
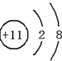 .
.(2)上述滴加氯水的整个过程中的还原剂是I-I2.
(3)用化学反应方程式表示出下层由紫色褪去的原因(产物中含有某+5价元素的含氧酸分子)I2+5Cl2+6H2O=2HIO3+10HCl.
分析 某化合物A的焰色反应为黄色,说明含有钠离子,在其溶液中滴加氯水和少许CCl4,振荡后,下层变成紫色,为单质碘,说明化合物A中含有碘离子,A为碘化钠;继续滴加氯水,振荡后,下层会逐渐变浅,最后紫色褪去,氯水可以把单质碘继续氧化生成碘酸钠.
(1)钠离子核外有2个电子层,分别容纳2,8个电子,核内有11个质子;
(2)氯气与碘化钠反应生成单质碘和氯化钠,氯气与单质碘反应生成碘酸和盐酸,依据元素化合价变化判断物质性质;
(3)氯气与单质碘反应生成碘酸和盐酸,据此写出反应方程式.
解答 解:(1)钠离子核外有2个电子层,分别容纳2,8个电子,核内有11个质子,结构示意图: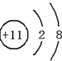 ;
;
故答案为: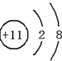 ;
;
(2)
氯气与碘化钠反应生成单质碘和氯化钠,反应中-1价的碘离子化合价升高被氧化,所以碘离子为还原剂;氯气单与质碘反应生成碘酸和盐酸,0价的碘化合价升高,所以碘单质为还原剂;
故答案为:I-;I2;
(3)氯气与单质碘反应生成碘酸和盐酸,化学方程式:I2+5Cl2+6H2O=2HIO3+10HCl;
故答案为:I2+5Cl2+6H2O=2HIO3+10HCl.
点评 本题考查了元素化合物知识,明确钠的焰色反应,卤族元素性质是解题关键,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
4.既能跟盐酸反应,又能跟氢氧化钠溶液反应的氢氧化物是( )
| A. | Al2O3 | B. | MgO | C. | NaHCO3 | D. | Al(OH)3 |
18.短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素最外层电子数是其内层电子总数3倍;C元素原子M层电子数是K层电子数的3倍;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )
| A. | C>D>B>A | B. | D>B>A>C | C. | A>D>C>B | D. | B>A>C>D |
5.“绿色化学”是当今社会提出的一个新概念,在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%.以下反应最符合绿色化学原子经济性要求的是( )
| A. | 铜和浓硝酸为原料生产硝酸铜 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 乙烯与HCl制取氯乙烷 | D. | 由反应2SO2+02?2SO3制SO3 |
2.下列说法正确的是( )
| A. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| B. | 室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均减小 | |
| C. | 向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| D. | 向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
3.CuO、Fe铁粉、Fe3O4混合物中,加一定量稀H2SO4并微热,当反应停止后,滤出不溶物,并向溶液中插入一枚铁钉,片刻后取出铁钉,发现铁钉并无变化,根据上述现象,确定下面结论中正确的是( )
| A. | 稀硫酸可能过量 | |
| B. | 不溶物中一定含有Fe | |
| C. | 不溶物中一定含有 Cu,但不一定含有Fe | |
| D. | 滤液中一定含有Fe(SO4)3,但不一定含有FeSO4 |
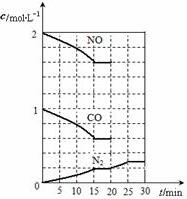 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.