题目内容
14.处于下列状态的物质中:①氯化钠晶体 ②干冰 ③液态醋酸④铜 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔融的硝酸钾 ⑨NaCl溶液(1)属于电解质的是(填序号,下同)①③⑤⑧;
(2)能导电的是④⑧⑨.
分析 在水溶液或者熔融状态下能导电的化合物属于电解质;
在水溶液和熔融状态下都不导电的化合物属于非电解质;
物质导电的条件是含有自由电子或者自由离子.
解答 解:①氯化钠晶体不能导电,溶于水或熔融状态下能导电,属于电解质;
②干冰不能导电,属于非的非电解质;
③液态醋酸不能导电,溶于水能导电,属于电解质;
④铜能导电,是金属单质,既不是电解质也不是非电解质;
⑤硫酸钡晶体不能导电,熔融状态能导电,属于电解质;
⑥蔗糖不能导电,属于非电解质;
⑦酒精不能导电,属于非电解质;
⑧熔融的硝酸钾能导电,属于电解质;
⑨NaCl溶液能导电,属于混合物,既不是电解质也不是非电解质,
故答案为:(1)①③⑤⑧;(2)④⑧⑨.
点评 本题考查了化学的基本概念,题目难度不大,熟悉电解质、非电解质、强弱电解质的概念是解题关键,注意电解质不一定能导电,导电的不一定是电解质,单质和混合物既不是电解质,也不是非电解质.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
4.既能跟盐酸反应,又能跟氢氧化钠溶液反应的氢氧化物是( )
| A. | Al2O3 | B. | MgO | C. | NaHCO3 | D. | Al(OH)3 |
5.“绿色化学”是当今社会提出的一个新概念,在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%.以下反应最符合绿色化学原子经济性要求的是( )
| A. | 铜和浓硝酸为原料生产硝酸铜 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 乙烯与HCl制取氯乙烷 | D. | 由反应2SO2+02?2SO3制SO3 |
2.下列说法正确的是( )
| A. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| B. | 室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均减小 | |
| C. | 向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| D. | 向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
9.25℃时,0.1mol/L HCl中,下列说法正确的是( )
| A. | c(H+)×c(OH-)=1×10-14 | B. | 该溶液中由水电离出的c(H+)=1×10-7 | ||
| C. | c(H+)=c(OH-)=1×10-7 | D. | c(H+)×c(OH-)=1 |
6.下列有关微粒表示正确且不影响水的电离的是( )
| A. | 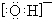 | B. | 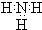 | C. | 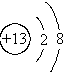 | D. | 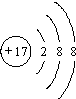 |
3.CuO、Fe铁粉、Fe3O4混合物中,加一定量稀H2SO4并微热,当反应停止后,滤出不溶物,并向溶液中插入一枚铁钉,片刻后取出铁钉,发现铁钉并无变化,根据上述现象,确定下面结论中正确的是( )
| A. | 稀硫酸可能过量 | |
| B. | 不溶物中一定含有Fe | |
| C. | 不溶物中一定含有 Cu,但不一定含有Fe | |
| D. | 滤液中一定含有Fe(SO4)3,但不一定含有FeSO4 |
4.下列应用元素周期律得到的推断中,正确的是( )
| A. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| B. | 氟的非金属性比氯强,其最高价氧化物对应水化物的酸性比HClO4强 | |
| C. | 硒(Se)位于第四周期 VIA,其气态氢化物不如HCl稳定 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |