题目内容
15.在电解质溶液中,一定相等的是( )| A. | 阴离子数和阳离子数 | |
| B. | 阳离子的正电荷总数和阴离子的负电荷总数 | |
| C. | 阴、阳离子的质量 | |
| D. | 每个阳离子与每个阴离子所带的电荷 |
分析 A、从电解质溶液中所含的离子所带电荷和电荷守恒分析判断;
B、电解质溶液呈中性,根据电荷守恒分析;
C、从弱电解质的电离平衡分析判断;
D、溶液中阳离子带的正电荷总数一定和阴离子带的负电荷总数相等.
解答 解:A、电解质溶液中的离子可以是带一个电荷,也可以带两个电荷或三个电荷,根据整个电解质溶液呈中性,则阳离子和阴离子数目不一定相等,故A错误;
B、整个电解质溶液呈中性,存在电荷守恒,阳离子带的正电荷总数一定和阴离子带的负电荷总数相等,故B正确;
C、阴、阳离子的质量不一定相等,如氯化钠溶液中钠离子和氯离子的质量不等,故C错误;
D、溶液呈中性,存在电荷守恒,阳离子带的正电荷总数一定和阴离子带的负电荷总数相等,但是每个阳离子与每个阴离子所带的电荷不一定相等,故D错误;
故选B.
点评 本题考查了电解质溶液的电荷守恒,弱电解质的电离平衡,溶液导电的原因,A选项为学生解答中的易错点,注意离子的电荷可能不同来解答.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
5.“绿色化学”是当今社会提出的一个新概念,在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%.以下反应最符合绿色化学原子经济性要求的是( )
| A. | 铜和浓硝酸为原料生产硝酸铜 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 乙烯与HCl制取氯乙烷 | D. | 由反应2SO2+02?2SO3制SO3 |
6.下列有关微粒表示正确且不影响水的电离的是( )
| A. | 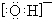 | B. | 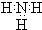 | C. | 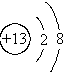 | D. | 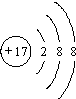 |
3.CuO、Fe铁粉、Fe3O4混合物中,加一定量稀H2SO4并微热,当反应停止后,滤出不溶物,并向溶液中插入一枚铁钉,片刻后取出铁钉,发现铁钉并无变化,根据上述现象,确定下面结论中正确的是( )
| A. | 稀硫酸可能过量 | |
| B. | 不溶物中一定含有Fe | |
| C. | 不溶物中一定含有 Cu,但不一定含有Fe | |
| D. | 滤液中一定含有Fe(SO4)3,但不一定含有FeSO4 |
10.如果你家里的食用花生油不小心混入了大量的水,利用你所学的知识,采用最简便的分离方法是( )
| A. | .蒸发 | B. | 分液 | C. | .蒸馏 | D. | 萃取 |
7.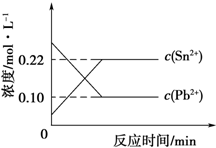 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入少量 Sn(NO3)2固体后,c(Pb2+)变大 | |
| C. | 往平衡体系中加入少量金属铅后,c(Pb2+)增大 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H<0 |
4.下列应用元素周期律得到的推断中,正确的是( )
| A. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| B. | 氟的非金属性比氯强,其最高价氧化物对应水化物的酸性比HClO4强 | |
| C. | 硒(Se)位于第四周期 VIA,其气态氢化物不如HCl稳定 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
5.下列实验事实能用平衡移动原理解释的是( )
| A. | 反应I2(g)+H2(g)?2H I(g) 达平衡后,压缩体积体系颜色变深 | |
| B. | H2O2中加入二氧化锰,生成氧气的速率加快 | |
| C. | 棕黄色的FeCl3溶液中加入铁粉颜色逐渐变为浅绿色 | |
| D. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |