题目内容
11.下列有关说法正确的是( )| A. | 化学反应的平衡常数越大,反应进行的速率越快 | |
| B. | 加热、蒸干NaAlO2溶液和AlCl3溶液,并灼烧都得到Al2O3 | |
| C. | CH3COOH 溶液加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变 | |
| D. | 0.1mol•L-1CH3COONa溶液中加入少量固体NaOH,碱性增强,平衡向水解方向移动 |
分析 A、平衡常数越大,正向进行的程度大,不能确定反应速率大小;
B、根据这两种盐水解时生成物的性质分析判断最终灼烧物质;
C、$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的分子和分母同乘以氢离子的浓度等于$\frac{{K}_{a}}{{K}_{w}}$,而Ka和Kw两者都是温度的函数;
D、CH3COONa溶液水解呈碱性,加入少量固体NaOH,氢氧根离子浓度变大,抑制水解.
解答 解:A、平衡常数越大,正向进行的程度大,不能确定反应速率大小,故A错误;
B、加热偏铝酸钠溶液时,偏铝酸钠溶液水解生成氢氧化钠和氢氧化铝,蒸干灼烧氢氧化钠和氢氧化铝的混合物得到的物质是氢氧化钠和氧化铝;加热氯化铝溶液时,氯化铝水解生成氯化氢和氢氧化铝,盐酸易挥发,导致铝离子水解程度加深,蒸干灼烧时,氢氧化铝分解生成氧化铝,所以两种盐溶液得到的物质不都是氧化铝,故B错误;
C、$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的分子和分母同乘以氢离子的浓度等于$\frac{{K}_{a}}{{K}_{w}}$,而Ka和Kw两者都是温度的函数,温度不变Ka和Kw不变,所以溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变,故C正确;
D、CH3COONa溶液水解呈碱性,加入少量固体NaOH,氢氧根离子浓度变大,抑制水解,所以水解平衡逆向移动,故D错误;
故选C.
点评 本题考查外界条件对水解平衡的影响,重点考查离子浓度以及同离子效应对电离平衡的影响,注意总结影响因素以及平衡移动的方向的判断.

| A. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| B. | 室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均减小 | |
| C. | 向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| D. | 向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
| A. | 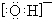 | B. | 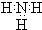 | C. | 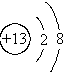 | D. | 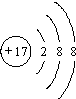 |
| A. | 稀硫酸可能过量 | |
| B. | 不溶物中一定含有Fe | |
| C. | 不溶物中一定含有 Cu,但不一定含有Fe | |
| D. | 滤液中一定含有Fe(SO4)3,但不一定含有FeSO4 |
| A. | 硫酸中放出氢气量最多 | B. | 反应速率H2SO4>HCl>CH3COOH | ||
| C. | 放出氢气量:HCl>CH3COOH | D. | 放出氢气量:HCl=CH3COOH |
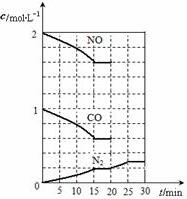 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.