题目内容
12.(1)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol.若1g水蒸气转化成液态水放热2.5kJ,则氢气的燃烧热为△H=-286.8kJ/mol.(2)近年来已经研制出甲烷(CH4)燃料电池,该电池的电解质溶液为H2SO4溶液,写出该电池负极的电极反应式:CH4-8e-+2H2O=CO2+8H+.该电池总反应式:CH4+2O2=CO2+2H2O.
(3)用惰性电极电解AgNO3溶液,写出该电解反应的化学方程式4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+4HNO3+O2↑;若在阳极收集到 0.32g O2,中和电解生成的酸需0.4mol•L-1NaOH溶液100 mL.
分析 (1)根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式,方程中的热量和化学计量数要对应;
(2)CH4燃料电池中,CH4从负极通入,在反应中失电子被氧化,酸性条件下生成二氧化碳和水;
(3)用惰性电极电解AgNO3溶液,阳极发生4OH--4e-=2H2O+O2↑,阴极发生4Ag++4e-=4Ag,所以电解总方程:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag↓+4HNO3+O2↑,根据产生氧气的量计算产生硝酸的量,根据硝酸和氢氧化钠的量之间的关系来计算.
解答 解:(1)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol;1g水蒸气转化成液态水放热2.5kJ,故18g水蒸气转化成液态水放出热量2.5kJ×18=45kJ,故反应H2(g)+$\frac{1}{2}$O2(g)═H2O(l)的反应热△H=-(241.8kJ/mol+45kJ/mol)=-286.8kJ/mol,故氢气的燃烧热为286.8kJ/mol;
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol;-286.8;
(2)在CH4燃料电池中,负极上是燃料CH4发生失电子的氧化反应,在酸性环境下,电极反应为:CH4-8e-+2H2O=CO2+8H+,总反应式为CH4+2O2=CO2+2H2O,
故答案为:CH4-8e-+2H2O=CO2+8H+;CH4+2O2=CO2+2H2O;
(3)用惰性电极电解AgNO3溶液,阳极发生4OH--4e-=2H2O+O2↑,阴极发生4Ag++4e-=4Ag,所以电解总方程:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag↓+4HNO3+O2↑,在阳极上收集到0.32gO2即0.01mol氧气(标准状况下),转移电子是0.04mol,根据反应:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+4HNO3+O2↑,生成硝酸是0.04mol,消耗0.04mol氢氧化钠来将之中和,所以NaOH溶液的物质的量浓度为$\frac{0.04mol}{0.4mol•{L}^{-1}}$=0.1L=100ml.故答案为:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+4HNO3+O2↑;100.
点评 本题考查了CH4燃烧热的热化学方程式书写、原电池原理的应用,主要考查了燃料电池的电极方程式的书写,题目难度不大,注意电解质溶液的酸碱性对电极方程式的影响.

| A. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| B. | 室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均减小 | |
| C. | 向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| D. | 向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
| A. | 稀硫酸可能过量 | |
| B. | 不溶物中一定含有Fe | |
| C. | 不溶物中一定含有 Cu,但不一定含有Fe | |
| D. | 滤液中一定含有Fe(SO4)3,但不一定含有FeSO4 |
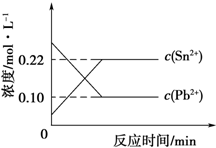 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入少量 Sn(NO3)2固体后,c(Pb2+)变大 | |
| C. | 往平衡体系中加入少量金属铅后,c(Pb2+)增大 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H<0 |
| A. | 稳定性:NH3>PH3>SiH4 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 还原性:F->Cl->Br- |
| A. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| B. | 氟的非金属性比氯强,其最高价氧化物对应水化物的酸性比HClO4强 | |
| C. | 硒(Se)位于第四周期 VIA,其气态氢化物不如HCl稳定 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
| A. | 硫酸中放出氢气量最多 | B. | 反应速率H2SO4>HCl>CH3COOH | ||
| C. | 放出氢气量:HCl>CH3COOH | D. | 放出氢气量:HCl=CH3COOH |
| A. | H2SO4+Ba(OH)2═BaSO4↓+2H2O | B. | 2HCl+Ba(OH)2═BaCl2+2H2O | ||
| C. | H2SO4+Cu(OH)2═CuSO4+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |