题目内容
下列溶液中有关微粒的物质的量浓度关系不正确的是( )
| A、物质的量浓度相等的Na2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| B、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C、常温下c(NH4+)相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中,溶质的物质的量浓度大小:①>②>③ |
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) |
考点:离子浓度大小的比较
专题:
分析:A、依据溶液中电荷守恒分析判断;
B、结合溶液中电荷守恒分析;
C、(NH4)2CO3溶液中的碳酸根离子和铵根离子相互促进水解,导致铵根离子浓度减小;
(NH4)2Fe(SO4)2溶液中的亚铁离子水解溶液显示酸性,铵根离子水解溶液显示酸性,亚铁离子的水解抑制了铵根离子水解;
(NH4)2SO4溶液铵根离子正常水解;铵根离子水解程度越大,相同物质的量浓度c(NH4+)的溶液中溶质的浓度越大,据此进行解答;
D、等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中HX电离大于X-的水解;
B、结合溶液中电荷守恒分析;
C、(NH4)2CO3溶液中的碳酸根离子和铵根离子相互促进水解,导致铵根离子浓度减小;
(NH4)2Fe(SO4)2溶液中的亚铁离子水解溶液显示酸性,铵根离子水解溶液显示酸性,亚铁离子的水解抑制了铵根离子水解;
(NH4)2SO4溶液铵根离子正常水解;铵根离子水解程度越大,相同物质的量浓度c(NH4+)的溶液中溶质的浓度越大,据此进行解答;
D、等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中HX电离大于X-的水解;
解答:
解:A、物质的量浓度相等的Na2S和NaHS混合溶液中存在电荷守恒:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故A正确;
B、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,溶液中电荷守恒为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-),则混合后溶液中:c(Na+)=c(CH3COO-)+c(Cl-)>c(OH-)=c(H+),故B错误;
C、(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液,(NH4)2CO3溶液中CO32-离子促进NH4+水解,(NH4)2Fe (SO4)2溶液中Fe2+抑制NH4+离子水解,如果溶液中c(NH4+)相等,则(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液的浓度大小顺序为:①>②>③,故C正确;
D、等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中HX电离大于X-的水解,溶液中离子浓度大小为:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故D正确;
故选B.
B、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,溶液中电荷守恒为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-),则混合后溶液中:c(Na+)=c(CH3COO-)+c(Cl-)>c(OH-)=c(H+),故B错误;
C、(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液,(NH4)2CO3溶液中CO32-离子促进NH4+水解,(NH4)2Fe (SO4)2溶液中Fe2+抑制NH4+离子水解,如果溶液中c(NH4+)相等,则(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液的浓度大小顺序为:①>②>③,故C正确;
D、等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中HX电离大于X-的水解,溶液中离子浓度大小为:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故D正确;
故选B.
点评:本题考查了电解质溶液中离子浓度大小比较方法,盐类水解影响因素分析,电荷守恒分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
下列反应中必须加入还原剂才能进行的是( )
| A、FeCl3→FeCl2 |
| B、Zn→Zn2+ |
| C、H2→H2O |
| D、CuO→CuCl2 |
下列离子方程式不正确的是( )
| A、向氢氧化钾溶液中滴加少量氯化铝溶液 Al3++4OH-=AlO2-+2H2O |
| B、在亚硫酸中加入过量的次氯酸钠溶液 H2SO3+3ClO-=Cl-+2HClO+SO42- |
| C、在稀HNO3溶液加入FeS固体 FeS+2H+=Fe2++H2S↑ |
| D、在过氧化钠中加入稀硫酸 2Na2O2+4H+=4Na++2H2O+O2↑ |
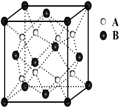 原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素.回答下列问题:
原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素.回答下列问题:
 ,所以它属于二肽
,所以它属于二肽 结构且能发生银镜反应 ②N原子直接与苯环相连③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,
结构且能发生银镜反应 ②N原子直接与苯环相连③核磁共振氢谱有5种峰且峰面积比1:1:2:2:3,