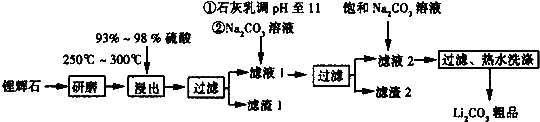
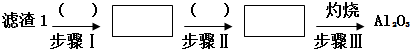题目内容
下列离子方程式不正确的是( )
| A、向氢氧化钾溶液中滴加少量氯化铝溶液 Al3++4OH-=AlO2-+2H2O |
| B、在亚硫酸中加入过量的次氯酸钠溶液 H2SO3+3ClO-=Cl-+2HClO+SO42- |
| C、在稀HNO3溶液加入FeS固体 FeS+2H+=Fe2++H2S↑ |
| D、在过氧化钠中加入稀硫酸 2Na2O2+4H+=4Na++2H2O+O2↑ |
考点:离子方程式的书写
专题:
分析:A.氯化铝少量,氢氧根离子过量,反应生成偏铝酸根离子核外水;
B.次氯酸具有强氧化性,能够将亚硫酸氧化成硫酸,次氯酸过量,反应产物为氯离子、硫酸根离子和次氯酸;
C.稀硝酸具有强氧化性,能够将氯化亚铁中硫离子、亚铁离子氧化,漏掉了亚铁离子与硝酸的反应;
D.过氧化钠稀硫酸反应生成硫酸钠、水和氧气.
B.次氯酸具有强氧化性,能够将亚硫酸氧化成硫酸,次氯酸过量,反应产物为氯离子、硫酸根离子和次氯酸;
C.稀硝酸具有强氧化性,能够将氯化亚铁中硫离子、亚铁离子氧化,漏掉了亚铁离子与硝酸的反应;
D.过氧化钠稀硫酸反应生成硫酸钠、水和氧气.
解答:
解:A.向氢氧化钾溶液中滴加少量氯化铝溶液,反应生成偏铝酸钾和水,反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,故A错误;
B.在亚硫酸中加入过量的次氯酸钠溶液,反应生成氯化钠、次氯酸和硫酸钠,反应的离子方程式为:H2SO3+3ClO-=Cl-+2HClO+SO42-,故B正确;
C.在稀HNO3溶液加入FeS固体,硫离子也会被氧化,正确的离子方程式为:NO3-+FeS+4H+═Fe3++S↓+NO↑+2H2O,故C错误;
D.过氧化钠中加入稀硫酸,反应生成硫酸钠、水和氧气,反应的离子方程式为:2Na2O2+4H+=4Na++2H2O+O2↑,故D正确;
故选C.
B.在亚硫酸中加入过量的次氯酸钠溶液,反应生成氯化钠、次氯酸和硫酸钠,反应的离子方程式为:H2SO3+3ClO-=Cl-+2HClO+SO42-,故B正确;
C.在稀HNO3溶液加入FeS固体,硫离子也会被氧化,正确的离子方程式为:NO3-+FeS+4H+═Fe3++S↓+NO↑+2H2O,故C错误;
D.过氧化钠中加入稀硫酸,反应生成硫酸钠、水和氧气,反应的离子方程式为:2Na2O2+4H+=4Na++2H2O+O2↑,故D正确;
故选C.
点评:本题考查了离子方程式的正误判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
根据下列三个反应的化学方程式:?I2+SO2+2H2O═H2SO4+2HI;2FeCl2+Cl2═2FeCl3,2FeCl3+2HI═2FeCl2+2HCl+I2有关物质的还原性依次增强的顺序是( )
?
?
| A、I->Fe2+>Cl->SO2 |
| B、Cl->Fe2+>SO2>I- |
| C、Fe2+>I->Cl->SO2 |
| D、SO2>I->Fe2+>Cl- |
下列溶液中,跟100mL 0.5mol/L CaCl2溶液所含的Cl-物质的量浓度相同的是( )
| A、100mL 1mol/L MgCl2溶液 |
| B、200mL 0.25mol/L AlCl3溶液 |
| C、200ml 1mol/L NaCl溶液 |
| D、200ml 0.5mol/L HCl溶液 |
下列关于胶体的叙述不正确的是( )
| A、胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7m之间 |
| B、胶体分散质的直径介于溶液和浊液分散质直径之间 |
| C、用激光笔照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
| D、Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 |
下列反应中可用离子方程式H++OH-═H2O表示的是( )
| A、NH4Cl+NaOH═NaCl+NH3?H2O |
| B、Mg(OH)2+2HCl═MgCl2+2H2O |
| C、NaOH+NaHCO3═Na2CO3+H2O |
| D、NaOH+HNO3═NaNO3+H2O |
下列说法中正确的是( )
| A、O2的摩尔质量是16g |
| B、碱性氧化物一定是金属氧化物,酸性氧化物一定是非金属氧化物 |
| C、碳酸钠溶液能使酚酞试液变红,因此它是碱 |
| D、虽然二氧化碳溶于水能导电,但它是非电解质 |
下列溶液中有关微粒的物质的量浓度关系不正确的是( )
| A、物质的量浓度相等的Na2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| B、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C、常温下c(NH4+)相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中,溶质的物质的量浓度大小:①>②>③ |
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) |
 如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.
如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.