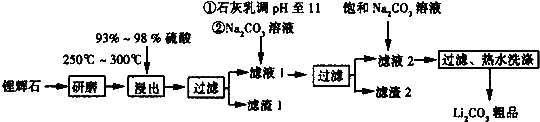
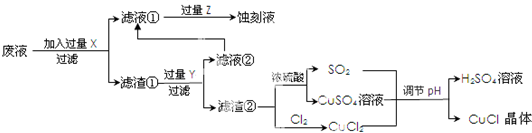
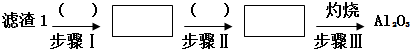题目内容
 原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素.回答下列问题:
原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素.回答下列问题:(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数为
(2)①.14g乙的单质分子中π键的个数为
②.+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第
③.戊的基态原子有
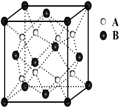
(3)丙和丁形成的一种离子化合物的晶胞结构如右图,该晶体中阴离子的配位数为
(4)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为
考点:位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题
分析:甲、乙、丙原子序数依次递增,甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2,故甲、乙、丙分别为C、N、O,戊元素是周期表中ds区的第一种元素,所以戊为Cu;丁与戊原子序数相差18,则丁为Na,
(1)碳单质中熔点较低的是C60,分子密堆积,每个分子周围紧邻的分子数为12个;熔点较高的有金刚石和石墨,金刚石中碳原子是sp3杂化,而石墨层状结构,碳原子是sp2杂化;
(2)①氮气分子中含有三键,三键是由1个δ键和2个π键构成的,14g氮气是0.5mol,所以分子中π键的个数为NA;
②钠是第IA元素,失去1个电子后,就达到稳定结构,所以电离能突增应出现在第二电离能;
③铜原子的基态原子轨道是s、p、d,所以有3种形状不同的原子轨道;
(3)根据晶胞(Na2O)结构可知,顶点和面心处是阴离子,阳离子全部在晶胞内,所以与钠离子最近的阴离子是4个,即配位数是4,而距一个阴离子周围最近的所有阳离子为顶点构成的几何体是正方体,该晶胞中含有4个阴离子;
(4)甲、乙都能和丙形成原子个数比为1:3的常见微粒分别是CO32-、NO3-,中心原子含σ键电子对数为3对.
(1)碳单质中熔点较低的是C60,分子密堆积,每个分子周围紧邻的分子数为12个;熔点较高的有金刚石和石墨,金刚石中碳原子是sp3杂化,而石墨层状结构,碳原子是sp2杂化;
(2)①氮气分子中含有三键,三键是由1个δ键和2个π键构成的,14g氮气是0.5mol,所以分子中π键的个数为NA;
②钠是第IA元素,失去1个电子后,就达到稳定结构,所以电离能突增应出现在第二电离能;
③铜原子的基态原子轨道是s、p、d,所以有3种形状不同的原子轨道;
(3)根据晶胞(Na2O)结构可知,顶点和面心处是阴离子,阳离子全部在晶胞内,所以与钠离子最近的阴离子是4个,即配位数是4,而距一个阴离子周围最近的所有阳离子为顶点构成的几何体是正方体,该晶胞中含有4个阴离子;
(4)甲、乙都能和丙形成原子个数比为1:3的常见微粒分别是CO32-、NO3-,中心原子含σ键电子对数为3对.
解答:
解:甲、乙、丙原子序数依次递增,甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2,故甲、乙、丙分别为C、N、O,戊元素是周期表中ds区的第一种元素,所以戊为Cu;丁与戊原子序数相差18,则丁为Na,
由分析知甲、乙、丙、丁、戊分别是C、N、O、Na、Cu元素,
(1)碳单质中熔点较低的是C60,分子密堆积,晶体结构类似于干冰,每个分子周围紧邻的分子数为:3×8×
=12个;
熔点较高的有金刚石和石墨,金刚石中碳原子全部形成4个共价键,所以是sp3杂化,而石墨层状结构,碳原子形成3个共价键,所以是sp2杂化,
故答案为:12;sp2;sp3;
(2)①氮气分子中含有三键,三键是由1个δ键和2个π键构成的,14g氮气物质的量为:
=0.5mol,所以14g氮气分子中π键的个数=2×0.5NA=NA,
故答案为:NA;
②钠是第IA元素,最外层有1个电子,失去1个电子后,就达到稳定结构,再失电子会很困难,所以电离能突增应出现在第二电离能,
故答案为:二;
③Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,可以看出铜原子的基态原子轨道是s、p、d,所以有3种形状不同的原子轨道,
故答案为:3;
(3)根据晶胞(Na2O)结构可知N(Na+):N(O2-)=2:1,所以顶点和面心处是阴离子,阳离子全部在晶胞内,所以与钠离子最近的阴离子是4个,即配位数是4.而距一个阴离子周围最近的所有阳离子为顶点构成的几何体是正方体,该晶胞中含有4个阴离子,所以有:
=4,解得:a=
,
故答案为:8;正方体(立方体);
;
(4)甲、乙都能和丙形成原子个数比为1:3的常见微粒分别是CO32-、NO3-,中心原子含σ键电子对数为3对,CO32-含有的电子对数=3+
=3,NO3-含有的电子对数为:3+
=3,所以都是平面三角形结构,
故答案为:平面三角形.
由分析知甲、乙、丙、丁、戊分别是C、N、O、Na、Cu元素,
(1)碳单质中熔点较低的是C60,分子密堆积,晶体结构类似于干冰,每个分子周围紧邻的分子数为:3×8×
| 1 |
| 2 |
熔点较高的有金刚石和石墨,金刚石中碳原子全部形成4个共价键,所以是sp3杂化,而石墨层状结构,碳原子形成3个共价键,所以是sp2杂化,
故答案为:12;sp2;sp3;
(2)①氮气分子中含有三键,三键是由1个δ键和2个π键构成的,14g氮气物质的量为:
| 14g |
| 28g/mol |
故答案为:NA;
②钠是第IA元素,最外层有1个电子,失去1个电子后,就达到稳定结构,再失电子会很困难,所以电离能突增应出现在第二电离能,
故答案为:二;
③Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,可以看出铜原子的基态原子轨道是s、p、d,所以有3种形状不同的原子轨道,
故答案为:3;
(3)根据晶胞(Na2O)结构可知N(Na+):N(O2-)=2:1,所以顶点和面心处是阴离子,阳离子全部在晶胞内,所以与钠离子最近的阴离子是4个,即配位数是4.而距一个阴离子周围最近的所有阳离子为顶点构成的几何体是正方体,该晶胞中含有4个阴离子,所以有:
| a3×ρ×NA |
| 62 |
| 3 |
| ||
故答案为:8;正方体(立方体);
| 3 |
| ||
(4)甲、乙都能和丙形成原子个数比为1:3的常见微粒分别是CO32-、NO3-,中心原子含σ键电子对数为3对,CO32-含有的电子对数=3+
| 4+2-2×3 |
| 2 |
| 5+1-2×3 |
| 2 |
故答案为:平面三角形.
点评:本题考查了晶胞的计算、核外电子排布、原子轨道杂化方式等内容,综合性较强,题目难度较大,注意利用均摊法解答晶胞的计算,试题充分考查了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
下列溶液中,跟100mL 0.5mol/L CaCl2溶液所含的Cl-物质的量浓度相同的是( )
| A、100mL 1mol/L MgCl2溶液 |
| B、200mL 0.25mol/L AlCl3溶液 |
| C、200ml 1mol/L NaCl溶液 |
| D、200ml 0.5mol/L HCl溶液 |
下列溶液中有关微粒的物质的量浓度关系不正确的是( )
| A、物质的量浓度相等的Na2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| B、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C、常温下c(NH4+)相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中,溶质的物质的量浓度大小:①>②>③ |
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) |
如图所示,电极a和b均为石墨棒,在电解过程中,下列说法正确的是( )
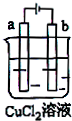

| A、电极a表面呈红色 |
| B、电极b表面有气泡生成 |
| C、电子由电源的正极沿导线流向电极a |
| D、该装置能量转化形式为电能转化为化学能 |
 如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.
如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.
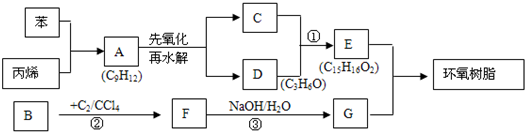
 .
.