题目内容
(1)同温、同压下等质量的SO2气体和CO2气体,体积之比
原子数目之比为 密度比为 氧元素的质量比为
(2)某气态氧化物化学式为RO2,在标准状下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为 ,R的相对原子质量为
(3)200mL、2.0mol/L的Al2(SO4)3溶液中含Al3+的物质的量为 从中取出10mL,将这10mL溶液用水稀释到50mL,所得溶液中SO42-的物质的量浓度为
(4)在标准状况下,w L氮气含有x个N2分子,则阿伏加德罗常数为 (用W X表示)
(5)将标准状况下的 a L HCl (g)溶于1000g水中,得到的盐酸密度为b g?cm-3,则该盐酸的物质的量浓度是 .
原子数目之比为
(2)某气态氧化物化学式为RO2,在标准状下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为
(3)200mL、2.0mol/L的Al2(SO4)3溶液中含Al3+的物质的量为
(4)在标准状况下,w L氮气含有x个N2分子,则阿伏加德罗常数为
(5)将标准状况下的 a L HCl (g)溶于1000g水中,得到的盐酸密度为b g?cm-3,则该盐酸的物质的量浓度是
考点:阿伏加德罗定律及推论,摩尔质量,阿伏加德罗常数,物质的量浓度的相关计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:(1)等质量的SO2和CO2,设质量均为m,物质的量之比为
:
=11:16,结合同温同压下物质的量与体积成正比、ρ=
及物质的构成来解答;
(2)根据n=
计算RO2的物质的量,再根据M=
计算其摩尔质量,进而计算R的相对原子质量;
(3)根据n=cV进行计算,稀释前后溶质的物质的量保持不变;
(4)标准状况下气体摩尔体积为22.4L/mol,根据n=
计算出WL氮气的物质的量,再根据阿伏伽德罗常数的表达式NA=
进行计算即可;
(5)先求氯化氢的物质的量,再根据溶液的质量、密度求出溶液的体积,根据物质的量浓度公式计算溶液的物质的量浓度.
| m |
| 64 |
| m |
| 44 |
| M |
| Vm |
(2)根据n=
| V |
| Vm |
| m |
| n |
(3)根据n=cV进行计算,稀释前后溶质的物质的量保持不变;
(4)标准状况下气体摩尔体积为22.4L/mol,根据n=
| V |
| Vm |
| N |
| n |
(5)先求氯化氢的物质的量,再根据溶液的质量、密度求出溶液的体积,根据物质的量浓度公式计算溶液的物质的量浓度.
解答:
解:(1)等质量的SO2和CO2,设质量均为m,物质的量之比为为
:
=11:16,都是三原子分子,原子数之比等于物质的量之比,即为11:16,含有的氧元素的物质的量之比是11:16,所以氧元素的质量之比是11:16,同温同压下物质的量与体积成正比,则体积之比为11:16,C.由ρ=
可知,摩尔质量与密度成正比,则密度之比为64g/mol:44g/mol=16:11,故答案为:11:16;11:16;16:11;11:16;
(2)RO2的物质的量的物质的量为
=0.02mol,其摩尔质量为
=64g/mol,R的相对原子质量为64-32=32,
故答案为:64g/mol;32;
(3)n=cV=2×0.2L×2.0mol/L=0.8mol;稀释前后,c1V1=c2V2,c2=
=1.2mol/L,
故答案为:0.8mol,1.2mol/L.
(4)标准状况下,WL氮气的物质的量为:n(N2)=
=
mol,
则阿伏伽德罗常数为:NA=
=
=
,故答案为:
;
(5)氯化氢的物质的量n=
,
氯化氢的质量m=nM=
,
溶液的体积V=
=
=
×10-3L,则c=
=
mol/L,
故答案为:
mol/L.
| m |
| 64 |
| m |
| 44 |
| M |
| Vm |
(2)RO2的物质的量的物质的量为
| 0.448L |
| 22.4L/mol |
| 1.28g |
| 0.02mol |
故答案为:64g/mol;32;
(3)n=cV=2×0.2L×2.0mol/L=0.8mol;稀释前后,c1V1=c2V2,c2=
| 3×2.0×10 |
| 50 |
故答案为:0.8mol,1.2mol/L.
(4)标准状况下,WL氮气的物质的量为:n(N2)=
| WL |
| 22.4L/mol |
| W |
| 22.4 |
则阿伏伽德罗常数为:NA=
| N |
| n |
| x | ||
|
| 22.4x |
| W |
| 22.4x |
| W |
(5)氯化氢的物质的量n=
| V |
| Vm |
氯化氢的质量m=nM=
| 36.5a |
| 22.4 |
溶液的体积V=
| m |
| ρ |
1000g+
| ||
| bg/cm3 |
| 22400+36.5a |
| 22.4b |
| n |
| V |
| 1000ab |
| 22400+36.5a |
故答案为:
| 1000ab |
| 22400+36.5a |
点评:本题考查的是物质的量、阿伏伽德罗常数的相关计算,正确判断溶液的体积是解本题的关键,注意不能把溶剂的体积当做溶液的体积.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
已知:(1)Zn(s)+
O2(g)=ZnO(s)△△H=-348.3kJ/mol
(2)2Ag(s)+
O2(g)=Ag2O(s)△H=-31.0kJ/mol
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△△H等于( )
| 1 |
| 2 |
(2)2Ag(s)+
| 1 |
| 2 |
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△△H等于( )
| A、-317.3 kJ/mol |
| B、-379.3 kJ/mol |
| C、-332.8 kJ/mol |
| D、+317.3 kJ/mol |
下列关于胶体的叙述不正确的是( )
| A、胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7m之间 |
| B、胶体分散质的直径介于溶液和浊液分散质直径之间 |
| C、用激光笔照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
| D、Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 |
下列说法中正确的是( )
| A、O2的摩尔质量是16g |
| B、碱性氧化物一定是金属氧化物,酸性氧化物一定是非金属氧化物 |
| C、碳酸钠溶液能使酚酞试液变红,因此它是碱 |
| D、虽然二氧化碳溶于水能导电,但它是非电解质 |
下列溶液中有关微粒的物质的量浓度关系不正确的是( )
| A、物质的量浓度相等的Na2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| B、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C、常温下c(NH4+)相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中,溶质的物质的量浓度大小:①>②>③ |
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) |

 如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.
如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.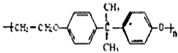
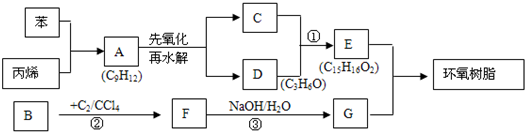
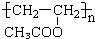 .
.