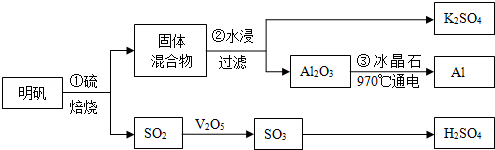
题目内容
5. 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;
②从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)=0.075mol/(L•min)(注明单位);H2的转化率=75%;
③下列说法中,能说明上述反应达到平衡状态的是C
A.每消耗1mol CO2的同时生成1mol CH3OH
B.CO2、H2、CH3OH和H2O的物质的量的比为1:3:1:1
C.容器中气体的压强不再改变
D.容器中气体的密度不再改变
④下列措施中,能使上述平衡状态向正反应方向移动的是BD
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用高效催化剂 D.恒温恒容再充入1molCO2和3mol H2.
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(2)二氧化碳是反应物,随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大,10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L,根据c=$\frac{△c}{△t}$计算v(CH3OH),由方程式可知△c(H2)=3c(CH3OH)=2.25mol/L,则△n(H2)=1L×2.25mol/L=2.25mol,再计算氢气转化率;
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(4)A.升高温度,平衡向吸热反应方向移动;
B.将CH3OH(g)及时液化抽出,减小生成物的量平衡正向进行;
C.选择高效催化剂不影响平衡移动;
D.再充入l molCO2和3molH2,增大压强,平衡向气体体积减小的方向移动.
解答 解:(1)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数表达式K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$,故答案为:$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;
(2)二氧化碳是反应物,随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大,10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L,
则v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),
由方程式可知△c(H2)=3c(CH3OH)=2.25mol/L,则△n(H2)=1L×2.25mol/L=2.25mol,氢气转化率=$\frac{2.25mol}{3mol}$×100%=75%,
故答案为:0.075mol/(L•min);75%;
(3)A.每消耗1mol CO2的同时生成1mol CH3OH,均表示正反应速率,反应始终按该比例关系进行,故A错误;
B.平衡时CO2、H2、CH3OH和H2O的物质的量的比,与反应物起始量及转化率有关,平衡时不一定等于化学计量数之比,故B错误;
C.随反应进行混合气体物质的量增大,恒温恒容下压强增大,当容器中气体的压强不再改变,说明到达平衡,故C正确;
D.混合气体总质量不变,容器的容积不变,容器中气体的密度为定值,故D错误,
故选:C;
(4)A.反应是放热反应,升温平衡逆向进行,故A错误;
B.将CH3OH(g)及时液化抽出,生成物浓度减小,平衡正向进行,故B正确;
C.选择高效催化剂只能改变速率,不影响化学平衡移动,故C错误;
D.再充入l molCO2和3molH2,增大压强,平衡正向进行,故D正确,
故选:BD.
点评 本题考查较为综合,涉及化学平衡计算与影响因素、平衡状态判断、平衡常数,侧重于学生的分析能力和计算能力的考查,为高考常见题型,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 甲烷燃烧 | B. | 碳酸钙高温分解 | ||
| C. | 锌片与稀硫酸反应 | D. | 钠与冷水反应 |
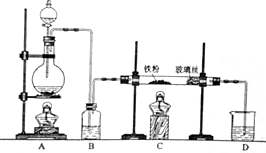
(1)某研究小组设计了制备Na2S2O3•5H2O装置和部分操作步骤如下.

Ⅰ.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热.
Ⅱ.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时即停止C中的反应,停止加热.
Ⅲ.过滤C中的混合液.
Ⅳ.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
①Ⅰ中,圆底烧瓶中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是Na2S2O3在酸性溶液中不能稳定存在.“停止C中的反应”的操作是打开K2,关闭K1.
③Ⅲ中,“过滤”用到的玻璃仪器是(填仪器名称)漏斗、玻璃棒、烧杯.
④装置B中盛放的试剂是(填化学式)NaOH溶液,其作用是在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染.
(2)依据反应2S2O32-+I2=S4O62-+2I-,可用I2的标准溶液测定产品的纯度.取5.5g产品,配制成100mL溶液.取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如表所示.
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
②Na2S2O3•5H2O在产品中的质量分数是(计算结果保留1位小数)90.2%.
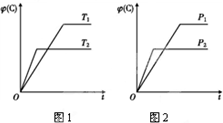 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示.下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示.下列叙述正确的是( )| A. | 平衡后,若使用催化剂,C的体积分数将增大 | |
| B. | 平衡后,若温度升高,化学平衡向正反应方向移动 | |
| C. | 平衡后,增加A的质量化学平衡向正反应方向移动 | |
| D. | 化学方程式中,化学计量数的关系为n<e+f |
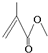 ,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.
,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.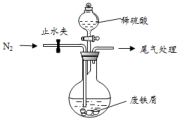 医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究: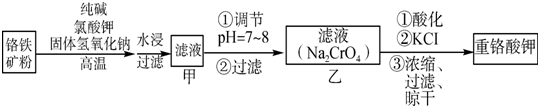
 某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
某研究性学习小组模拟工业生产过程进行试验.请回答下列问题: