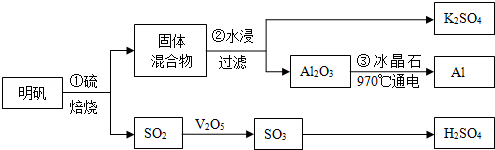
题目内容
8.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ•mol-1.
②已知:N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,则NO分子中化学键的键能为631.25kJ•mol-1.
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)×(10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO)×(10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前3s内的平均反应速率v (N2)=1.42×10-4mol•L-1•s-1.
②在该温度下,反应的平衡常数K=5000.(只写出计算结果)
③该可逆反应△S<0(填“>”、“<”或“=”),在低温(填“高温”、“低温”或“任何温度”)下能自发进行.
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是B

A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高.
分析 (1)①按顺序将三个热化学方程式编号为①②③,根据盖斯定律③×2-①-②可得;
②反应焓变=反应物键能总和-生成物键能总和;
(2)①依据化学反应速率是利用单位时间物质浓度的变化计算得到;
②依据图表数据结合平衡三段式列式计算平衡浓度,依据平衡常数概念分析计算得到;
③依据反应自发进行的判断依据分析△H-T△S<0,反应自发进行;
(3)A.负极的电极反应式为:CO+O2--2e-═CO2;
B.该燃料电池的正极反应为:O2+4e-=2O2-,生成的O2-由b极向a极迁移;
C.a电极是负极,b电极是正极,工作时电子由电极a通过传感器流向电极b;
D.传感器中通过的电流越大,尾气中CO的含量越高.
解答 解:(1)①按顺序将三个热化学方程式编号为①②③,根据盖斯定律③×2-自发进行①-②可得2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ•mol-1.
故答案为:-746.5 kJ•mol-1;
②N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,反应焓变=反应物键能总和-生成物键能总和,N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
设NO分子中化学键的键能为x
△H=946kJ•mol-1++497kJ•mol-1-2x=+180.5kJ•mol-1
则NO分子中化学键的键能x=631.25kJ•mol-1
故答案为:631.25;
(2)①v (N2)=$\frac{1}{2}$v (NO)=$\frac{1}{2}$×$\frac{{10.0×{{10}^{-4}}-1.5×{{10}^{-4}}}}{3}$=1.42×10-4mol•L-1•s-1
故答案为:1.42×10-4mol•L-1•s-1;
②反应至4s达平衡,此时
c(N2)=$\frac{1}{2}$△c(NO)=$\frac{1}{2}$×(10.0×10-4 mol•L-1-1.00×10-4 mol•L-1)=4.50×10-4 mol•L-1
c(CO2)=△c(NO)=10.0×10-4 mol•L-1-1.00×10-4 mol•L-1=9.00×10-4 mol•L-1
故化学平衡常数为:K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$=$\frac{4.5×1{0}^{-4}mol/L×(9×1{0}^{-4}mol/L)^{2}}{(1×1{0}^{-4})^{2}×(2.7×1{0}^{-3})^{2}}$=5000L•mol-1.
故答案为:5000;
③2NO(g)+2CO(g)═N2(g)+2CO2(g)反应熵变△S<0,低温反应自发进行
故答案为:<;低温;
(3)A.负极的电极反应式为:CO+O2--2e-═CO2,故A正确;
B.该燃料电池的正极反应为:O2+4e-=2O2-,生成的O2-由b极向a极迁移,故B错误;
C.a电极是负极,b电极是正极,工作时电子由电极a通过传感器流向电极b,故C正确;
D.传感器中通过的电流越大,尾气中CO的含量越高,故D正确;
故答案为:B.
点评 本题考查较为综合,涉及热化学方程式和盖斯定律的计算应用,为高频考点,侧重于学生的分析能力和计算能力的考查,题目涉及化学反应速率,化学平衡常数的计算应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 英国道尔顿----提出元素概念 | |
| B. | 法国拉瓦锡----提出原子学说 | |
| C. | 俄国门捷列夫---发现元素周期律 | |
| D. | 英国波义耳----建立燃烧现象的氧化学说 |
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、Cl- | D. | NH4+、K+、Cl-、NO3- |
(1)某研究小组设计了制备Na2S2O3•5H2O装置和部分操作步骤如下.

Ⅰ.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热.
Ⅱ.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时即停止C中的反应,停止加热.
Ⅲ.过滤C中的混合液.
Ⅳ.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
①Ⅰ中,圆底烧瓶中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是Na2S2O3在酸性溶液中不能稳定存在.“停止C中的反应”的操作是打开K2,关闭K1.
③Ⅲ中,“过滤”用到的玻璃仪器是(填仪器名称)漏斗、玻璃棒、烧杯.
④装置B中盛放的试剂是(填化学式)NaOH溶液,其作用是在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染.
(2)依据反应2S2O32-+I2=S4O62-+2I-,可用I2的标准溶液测定产品的纯度.取5.5g产品,配制成100mL溶液.取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如表所示.
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
②Na2S2O3•5H2O在产品中的质量分数是(计算结果保留1位小数)90.2%.
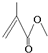 ,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.
,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.
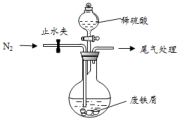 医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究: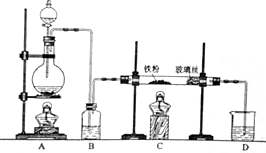 某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
某研究性学习小组模拟工业生产过程进行试验.请回答下列问题: