题目内容
6.锰及其化合物有广泛的用途.请回答下列问题:(1)①MnO2可用于制电池的材料,碱性锌锰电池的反应为2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2,其中MnOOH中Mn的化合价为+3,O在元素周期表的位置为第二周期VIA族
②由MnCO3可制得催化剂MnO2:2MnCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2MnO2+2CO2现在空气中加热23.0gMnCO3,一段时间后固体质量减轻2.8g,假设无其他物质生成,则制得MnO2的物质的量为0.1mol
(2)MnSO4作为肥料施进土壤,可以增产.从碳酸锰矿(主要成分为MnCO3、MnO2、FeCO3、SiO2、Al2O3)制备MnS O4溶液的操作如图所示
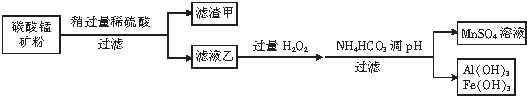
已知:MnO2难溶于水和冷硫酸,且氧化性比Fe3+强
①含杂质的碳酸锰矿使用前需将其粉碎,主要目的是增大接触面积,加快反应速率
②在滤液乙中锰元素只以Mn2十的形式存在,且滤渣甲中不含MnO2,则滤渣甲的主要成分是SiO2
请用离子方程式解释没有Mn O2的原因:MnO2+2Fe2++4H+=Mn2++2 Fe3++2H2O
③已知Ksp[Mn(OH)2]=4×10-18,Ksp[Fe(OH)3]=4×10-38,Ksp[Al(OH)3]=1×10-32常温下,为实现Mn2+和Al3+、Fe3+的分离,应使溶液中c(Fe3+)、c(Al3+)均小于或等于1×10-5mol.L-1,则至少应调节溶液pH=5;
(3)KMnO4不稳定,受热易分解,分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,最终的还原产物都是MnC12,若将nmolKMnO4粉末加热一段时间,收集到V1L气体后停止加热,冷却后加入足量的浓盐酸,再加热充分反应后,又收集到气体V2L,则V2=56n-2V1(用n、V1表示,气体均折算为标准状况下体积)
分析 (1)①MnOOH中O元素化合价为-2价、H元素化合价为+1价,该化学式中各元素化合价的代数和为1确定Mn的化合价;主族元素原子核外电子层数与其周期数相同,最外层电子数与其族序数相等,据此判断O在元素周期表的位置;
②根据减少的质量与生成的二氧化锰之间的关系式计算;
(2)碳酸锰矿主要成分为MnCO3、MnO2、FeCO3、SiO2、Al2O3,将碳酸锰矿中加入稍过量的稀硫酸,MnCO3、FeCO3、Al2O3和稀硫酸反应分别生成MnSO4、FeSO4、Al2(SO4)3,MnO2氧化性大于Fe3+,则MnO2和Fe2+在酸性条件下发生反应MnO2+2Fe2++4H+=Mn2++2 Fe3++2H2O,SiO2不反应,过滤后,滤渣成分为SiO2,滤液乙中含有MnSO4、Al2(SO4)3、Fe2(SO4)3,向滤液乙中加入过量双氧水,然后加入碳酸氢铵调节溶液的pH,过滤得到沉淀Al(OH)3、Fe(OH)3,滤液中溶质为MnSO4,
①反应物接触面积越大,反应速率越快;
②在滤液乙中锰元素只以Mn2十的形式存在,且滤渣甲中不含MnO2,则滤渣甲的主要成分是不溶于稀硫酸的二氧化硅;
酸性条件下,二氧化锰和亚铁离子发生氧化还原反应生成锰离子、铁离子和水;
③Fe3+完全沉淀时c(OH-)≥$\root{3}{\frac{4×1{0}^{-38}}{1{0}^{-5}}}$mol/L、Al3+完全沉淀时c(OH-)≥$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$mol/L>$\root{3}{\frac{4×1{0}^{-38}}{1{0}^{-5}}}$mol/L,铁离子需要的pH较小,铝离子需要的pH较大;如果使这两种两种都完全沉淀,则溶液中c(OH-)≥$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$mol/L=10-9mol/L,据此计算溶液的pH,根据溶度积常数计算此时溶液中Mn2十的浓度;
(3)KMnO4分解时Mn元素得电子、O元素失电子,生成氧气失去电子物质的量等于Mn得到电子的物质的量,生成的锰酸钾、二氧化锰都和浓盐酸反应生成锰离子和氯气,根据转移电子相等知,Mn元素得到电子的物质的量等于生成氯气失去电子的物质的量,则整个反应过程中高锰酸钾中Mn元素得到电子的物质的量等于生成氧气、氯气失去电子的物质的量之和,据此计算生成氯气体积.
解答 解:(1)①MnOOH中O元素化合价为-2价、H元素化合价为+1价,该化学式中各元素化合价的代数和为1确定Mn的化合价为+3;主族元素原子核外电子层数与其周期数相同,最外层电子数与其族序数相等,O原子核外有3个电子层、最外层电子数是6,所以O元素位于第二周期第VIA族,
故答案为:+3;二;VIA;
②设生成MnO2的物质的量为x,
2MnCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2MnO2+2CO2固体质量减少
2mol 56g
x 2.8g
2mol:56g=x:2.8g
x=$\frac{2mol×2.8g}{56g}$=0.1mol,
故答案为:0.1mol;
(2)碳酸锰矿主要成分为MnCO3、MnO2、FeCO3、SiO2、Al2O3,将碳酸锰矿中加入稍过量的稀硫酸,MnCO3、FeCO3、Al2O3和稀硫酸反应分别生成MnSO4、FeSO4、Al2(SO4)3,MnO2氧化性大于Fe3+,则MnO2和Fe2+在酸性条件下发生反应MnO2+2Fe2++4H+=Mn2++2 Fe3++2H2O,SiO2不反应,过滤后,滤渣成分为SiO2,滤液乙中含有MnSO4、Al2(SO4)3、Fe2(SO4)3,向滤液乙中加入过量双氧水,然后加入碳酸氢铵调节溶液的pH,过滤得到沉淀Al(OH)3、Fe(OH)3,滤液中溶质为MnSO4,
①反应物接触面积越大,反应速率越快,将含杂质的碳酸锰矿使用前需将其粉碎,增大反应物接触面积,反应速率加快,
故答案为:增大接触面积,加快反应速率;
②在滤液乙中锰元素只以Mn2十的形式存在,且滤渣甲中不含MnO2,则滤渣甲的主要成分是不溶于稀硫酸的SiO2;
酸性条件下,二氧化锰和亚铁离子发生氧化还原反应生成锰离子、铁离子和水,离子方程式为MnO2+2Fe2++4H+=Mn2++2 Fe3++2H2O,
故答案为:SiO2;MnO2+2Fe2++4H+=Mn2++2 Fe3++2H2O;
③Fe3+完全沉淀时c(OH-)≥$\root{3}{\frac{4×1{0}^{-38}}{1{0}^{-5}}}$mol/L、Al3+完全沉淀时c(OH-)≥$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$mol/L>$\root{3}{\frac{4×1{0}^{-38}}{1{0}^{-5}}}$mol/L,铁离子需要的pH较小,铝离子需要的pH较大;如果使这两种两种都完全沉淀,则溶液中c(OH-)≥$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$mol/L=10-9mol/L,溶液的pH=-lg$\frac{1{0}^{-14}}{1{0}^{-9}}$=5,
故答案为:5;
(3)KMnO4分解时Mn元素得电子、O元素失电子,生成氧气失去电子物质的量等于Mn得到电子的物质的量,生成的锰酸钾、二氧化锰都和浓盐酸反应生成锰离子和氯气,根据转移电子相等知,Mn元素得到电子的物质的量等于生成氯气失去电子的物质的量,则整个反应过程中高锰酸钾中Mn元素得到电子的物质的量等于生成氧气、氯气失去电子的物质的量之和,
设生成氯气体积为V2L,根据转移电子守恒得$\frac{{V}_{2}}{22.4}$mol×2+$\frac{{V}_{1}}{22.4}$mol×4=nmol×(7-2)
V=56n-2V1,故答案为:56n-2V1.
点评 本题考查物质制备,为高频考点,侧重考查学生阅读、获取信息、加工利用信息解答问题、计算及知识综合应用能力,明确元素化合物性质、化学反应原理是解本题关键,涉及方程式的计算、溶度积常数计算、化学反应速率影响因素等知识点,难点是溶液pH的计算,注意(3)题转移电子守恒的灵活应用,题目难点中等.

 考前必练系列答案
考前必练系列答案| A. | 合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 | |
| B. | 常温下,用蒸馏水不断稀释醋酸,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值变小 | |
| C. | 反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
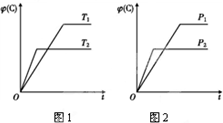 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示.下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示.下列叙述正确的是( )| A. | 平衡后,若使用催化剂,C的体积分数将增大 | |
| B. | 平衡后,若温度升高,化学平衡向正反应方向移动 | |
| C. | 平衡后,增加A的质量化学平衡向正反应方向移动 | |
| D. | 化学方程式中,化学计量数的关系为n<e+f |
| A. | HIO3 | B. | HIO2 | C. | HIO | D. | ICl |
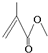 ,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.
,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.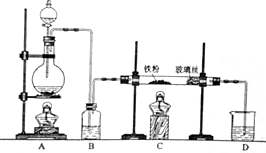 某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
某研究性学习小组模拟工业生产过程进行试验.请回答下列问题: