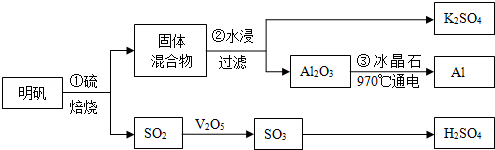
题目内容
9. 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: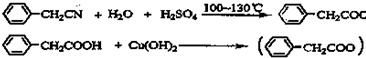
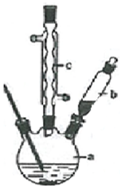
制备苯乙酸的装置示意图如下(加热和夹持装置等略).已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇.回答下列问题:
(1)在250mL三口瓶a中加入70mL70%硫酸.配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是先加水、再加入浓硫酸.
(2)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应.在装置中,仪器b的作用是滴加苯乙腈;仪器c的名称是球形冷凝管,其作用是回流(或使气化的反应液冷凝).
反应结束后加适量冷水,再分离出苯乙酸粗品.加人冷水的目的是便于苯乙酸析出.下列仪器中可用于分离苯乙酸粗品的是BCE(填标号).
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是重结晶,最终得到44g纯品,则苯乙酸的产率是95%.
(4)用CuCl2•2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是取最后一次少量洗涤液,加入稀硝酸,再加入AgNO3溶液,无白色浑浊出现.
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是增大苯乙酸溶解度,便于充分反应.
分析 (1)配制此硫酸时,应将密度大的注入密度小的液体中,防止混合时放出热使液滴飞溅;
(2)由图可知,c为冷凝管,使气化的液体冷凝回流,仪器b可加入反应液;反应结束后加适量冷水,降低温度,减小苯乙酸的溶解度;分离苯乙酸粗品,利用过滤操作;
(3)苯乙酸微溶于冷水,在水中的溶解度较小;由反应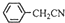 +H2O+H2SO4 $\stackrel{100-130℃}{→}$
+H2O+H2SO4 $\stackrel{100-130℃}{→}$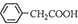 +NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g;
+NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g;
(4)用蒸馏水洗涤沉淀,将氯离子洗涤干净,利用硝酸银检验洗涤液确定是否洗涤干净;
(5)苯乙酸微溶于冷水,溶于乙醇,混合溶剂中乙醇可增大苯乙酸的溶解度.
解答 解:(1)稀释浓硫酸放出大量的热,配制此硫酸时,应将密度大的注入密度小的液体中,防止混合时放出热使液滴飞溅,则加入蒸馏水与浓硫酸的先后顺序是先加水、再加入浓硫酸,
故答案为:先加水、再加入浓硫酸;
(2)由图可知,c为球形冷凝管,其作用为回流(或使气化的反应液冷凝),仪器b的作用为滴加苯乙腈;反应结束后加适量冷水,降低温度,减小苯乙酸的溶解度,则加入冷水可便于苯乙酸析出;分离苯乙酸粗品,利用过滤操作,则需要的仪器为漏斗、烧杯、玻璃棒,
故答案为:滴加苯乙腈;球形冷凝管;回流(或使气化的反应液冷凝);便于苯乙酸析出;BCE;
(3)苯乙酸微溶于冷水,在水中的溶解度较小,则提纯苯乙酸的方法是重结晶;由反应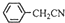 +H2O+H2SO4 $\stackrel{100-130℃}{→}$
+H2O+H2SO4 $\stackrel{100-130℃}{→}$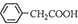 +NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g,最终得到44g纯品,则苯乙酸的产率是$\frac{44g}{46.5g}$×100%=95%,
+NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g,最终得到44g纯品,则苯乙酸的产率是$\frac{44g}{46.5g}$×100%=95%,
故答案为:重结晶;95%;
(4)用蒸馏水洗涤沉淀,将氯离子洗涤干净,利用硝酸银检验洗涤液确定是否洗涤干净,则沉淀洗干净的实验操作和现象是取最后一次少量洗涤液,加入稀硝酸,再加入AgNO3溶液,无白色浑浊出现,
故答案为:取最后一次少量洗涤液,加入稀硝酸,再加入AgNO3溶液,无白色浑浊出现;
(5)苯乙酸微溶于冷水,溶于乙醇,混合溶剂中乙醇可增大苯乙酸的溶解度,然后与Cu(OH)2反应除去苯乙酸,即混合溶剂中乙醇的作用是增大苯乙酸溶解度,便于充分反应,故答案为:增大苯乙酸溶解度,便于充分反应.
点评 本题为2014年广西高考化学试题,侧重物质制备实验及有机物性质的考查,把握合成反应及实验装置的作用为解答的关键,综合考查学生实验技能和分析解答问题的能力,题目难度中等,注意信息的处理及应用.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、Cl- | D. | NH4+、K+、Cl-、NO3- |
(1)某研究小组设计了制备Na2S2O3•5H2O装置和部分操作步骤如下.

Ⅰ.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热.
Ⅱ.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时即停止C中的反应,停止加热.
Ⅲ.过滤C中的混合液.
Ⅳ.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
①Ⅰ中,圆底烧瓶中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是Na2S2O3在酸性溶液中不能稳定存在.“停止C中的反应”的操作是打开K2,关闭K1.
③Ⅲ中,“过滤”用到的玻璃仪器是(填仪器名称)漏斗、玻璃棒、烧杯.
④装置B中盛放的试剂是(填化学式)NaOH溶液,其作用是在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染.
(2)依据反应2S2O32-+I2=S4O62-+2I-,可用I2的标准溶液测定产品的纯度.取5.5g产品,配制成100mL溶液.取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如表所示.
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
②Na2S2O3•5H2O在产品中的质量分数是(计算结果保留1位小数)90.2%.
(1)已知:FeO(s)+CO(g)?FeO(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如右表:
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
②在体积固定的密闭容器中该反应达到平衡状态后,升高温度混合气体的平均相对分子质
量减小(填“增大”、“减小”或“不变”)曰该反应正反应是放热反应(填“吸热”或“放热”).
(2)常温下,下列溶液的浓度均为0.1mol•L-1,测得溶液pH值如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②由表中数据分析,0.01mol•L-1的下列溶液,酸性最弱的是C(填编号).
A、H2CO3 B、HClO C、C6H5OH D、CH3COOH
③向氯水中加入少量的碳酸钠,可以增加氯水中HClO的浓度.为什么?Cl2+H2O?H++Cl-+HClO和2H++CO32-═CO2↑+H2O,少量的Na2CO3可以消耗H+使上述平衡正向移动,增大HClO的浓度.(请结合化学反应简要说明)
| A. | 合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 | |
| B. | 常温下,用蒸馏水不断稀释醋酸,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值变小 | |
| C. | 反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
| A. | 密闭容器中,9.6g 硫粉与 11.2g 铁粉混合加热生成硫化亚铁 17.6g 时,放出 19.12KJ 热量.则Fe(s)+S(s)═FeS(s)△H=-95.6KJ?mol-1 | |
| B. | 稀醋酸与 0.1mol?L-1NaOH 溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ?mol-1 | |
| C. | 已知,1molH2 完全燃烧生成液态水所放出的热量为 285.5KJ,则水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=-285.5KJ?mol-1 | |
| D. | 已知 2C(s)+O2(g)═2CO(g)△H=-221KJ?mol-1,则可知 C 的燃烧热△H=-110.5KJ?mol-1 |
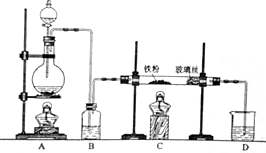 某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
某研究性学习小组模拟工业生产过程进行试验.请回答下列问题: