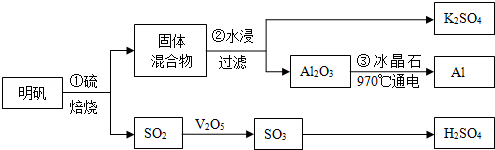
题目内容
12.氢能是高效、清洁能源,制氢技术的研究开发是氢能利用的必由之路.燃料水蒸气重整法是一种有效、经济、广泛采用的制氢方法,它是通过水蒸气与燃料间的反应来制取氢气的(1)在催化剂作用下,天然气和水蒸气反应可制得一氧化碳和氢气,已知该反应每制得2g氢气需要吸收6.88×102kJ热量.写出该反应的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+2.1×103kJ•mol-1或$\frac{1}{3}$CH4(g)+$\frac{1}{3}$H2O(g)=$\frac{1}{3}$CO(g)+H2(g)△H=+6.88×102kJ•mol-1;
(2)CO可继续与水蒸气反应:CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.0kJ•mol-1.若将1mol甲烷与足量水蒸气充分反应写出该反应的方程式CH4(g)+2H2O(g)=CO2(g)+4H2(g);
(3)欲制得较纯净的氢气可将(2)中充分反应后的气体通过足量的烧碱溶液,写出该反应的离子方程式2OH-+CO2=CO32-+H2O;
(4)将(2)的反应放在固定容器中,反应过程中压强怎样变化(填变大,不变,减小)不变.
分析 (1)每制得2g氢气需要吸收6.88×102kJ热量,即生成1mol氢气吸收6.88×102kJ热量,则生成3mol氢气吸收2.1×103 kJ热量,结合物质的状态书写热化学方程式;
(2)由CH4(g)+H2O(g)=CO(g)+3H2(g)、CO(g)+H2O(g)=CO2(g)+H2(g)可知,两式相加得到甲烷与水蒸气反应方程式;
(3)二氧化碳与足量NaOH反应生成碳酸钠和水;
(4)CO(g)+H2O(g)=CO2(g)+H2(g)为反应前后气体体积不变的反应.
解答 解:(1)每制得2g氢气需要吸收6.88×102kJ热量,即生成1mol氢气吸收6.88×102kJ热量,则生成3mol氢气吸收2.1×103 kJ热量,则热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+2.1×103 kJ•mol-1或$\frac{1}{3}$CH4(g)+$\frac{1}{3}$H2O(g)=$\frac{1}{3}$CO(g)+H2(g)△H=+6.88×102 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+2.1×103 kJ•mol-1或$\frac{1}{3}$CH4(g)+$\frac{1}{3}$H2O(g)=$\frac{1}{3}$CO(g)+H2(g)△H=+6.88×102 kJ•mol-1;
(2)由CH4(g)+H2O(g)=CO(g)+3H2(g)、CO(g)+H2O(g)=CO2(g)+H2(g)可知,两式相加得到甲烷与水蒸气反应方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g),
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g);
(3)二氧化碳与足量NaOH反应生成碳酸钠和水,而氢气不反应,涉及的离子反应为2OH-+CO2=CO32-+H2O,
故答案为:2OH-+CO2=CO32-+H2O;
(4)CO(g)+H2O(g)=CO2(g)+H2(g)为反应前后气体体积不变的反应,则固定容积时,反应过程中压强不变,故答案为:不变.
点评 本题考查反应热与焓变,为高频考点,把握热化学方程式的书写、反应中能量变化为解答的关键,侧重分析与应用能力的考查,注意平衡移动及盖斯定律应用,题目难度不大.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | 标准状况下,单位物质的量的气体所占的体积就叫气体的摩尔体积 | |
| B. | 物质的量是表示一定数目粒子集合体的一个物理量 | |
| C. | 0.012kg的碳中所含的碳原子数就是阿伏伽德罗常数 | |
| D. | Al原子的摩尔质量为27g,Al3+因少了3个电子,摩尔质量更小 |
(1)某研究小组设计了制备Na2S2O3•5H2O装置和部分操作步骤如下.

Ⅰ.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热.
Ⅱ.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时即停止C中的反应,停止加热.
Ⅲ.过滤C中的混合液.
Ⅳ.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
①Ⅰ中,圆底烧瓶中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是Na2S2O3在酸性溶液中不能稳定存在.“停止C中的反应”的操作是打开K2,关闭K1.
③Ⅲ中,“过滤”用到的玻璃仪器是(填仪器名称)漏斗、玻璃棒、烧杯.
④装置B中盛放的试剂是(填化学式)NaOH溶液,其作用是在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染.
(2)依据反应2S2O32-+I2=S4O62-+2I-,可用I2的标准溶液测定产品的纯度.取5.5g产品,配制成100mL溶液.取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如表所示.
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
②Na2S2O3•5H2O在产品中的质量分数是(计算结果保留1位小数)90.2%.
(1)已知:FeO(s)+CO(g)?FeO(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如右表:
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
②在体积固定的密闭容器中该反应达到平衡状态后,升高温度混合气体的平均相对分子质
量减小(填“增大”、“减小”或“不变”)曰该反应正反应是放热反应(填“吸热”或“放热”).
(2)常温下,下列溶液的浓度均为0.1mol•L-1,测得溶液pH值如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②由表中数据分析,0.01mol•L-1的下列溶液,酸性最弱的是C(填编号).
A、H2CO3 B、HClO C、C6H5OH D、CH3COOH
③向氯水中加入少量的碳酸钠,可以增加氯水中HClO的浓度.为什么?Cl2+H2O?H++Cl-+HClO和2H++CO32-═CO2↑+H2O,少量的Na2CO3可以消耗H+使上述平衡正向移动,增大HClO的浓度.(请结合化学反应简要说明)
| A. | 合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 | |
| B. | 常温下,用蒸馏水不断稀释醋酸,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值变小 | |
| C. | 反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
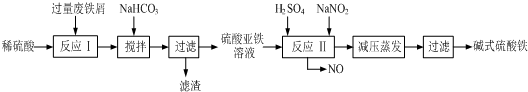
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH,除去溶液中Al3+(使溶液中Al3+生成氢氧化物沉淀),该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行.
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O或Fe2++H2O+NO2-=Fe(OH)2++NO↑+H+,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是2H2O+4NO+O2=4HNO3(或2NO+O2=2NO23NO2+H2O=2HNO3+NO).(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在常温减压条件下的原因是防止蒸发时温度过高,碱式硫酸铁进一步水解生成Fe(OH)3.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.

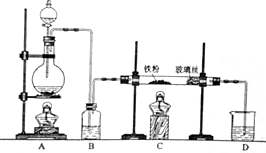 某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
某研究性学习小组模拟工业生产过程进行试验.请回答下列问题: