题目内容
12.保持温度不变,用惰性电极电解足量饱和的Na2CO3溶液,一段时间后下列叙述正确的是( )| A. | Na2CO3溶液的碱性增强 | |
| B. | 阳极反应:CO32--2e-+H2O═CO2↑+2OH- | |
| C. | 溶液中CO32-+H2O?HCO3-+OH-平衡不移动 | |
| D. | 向溶液中加入一定量HCOOH的能复原 |
分析 保持温度不变,用惰性电极电解足量饱和的Na2CO3溶液,阳极反应式为4OH--4e-=O2↑+2H2O、阴极反应式为2H++2e-=H2↑,所以实质上是解水,电解过程中导致溶液为过饱和溶液,会析出Na2CO3.10H2O,溶液中溶质为Na2CO3且浓度不变,据此分析解答.
解答 解:保持温度不变,用惰性电极电解足量饱和的Na2CO3溶液,阳极反应式为4OH--4e-=O2↑+2H2O、阴极反应式为2H++2e-=H2↑,所以实质上是解水,电解过程中导致溶液为过饱和溶液,会析出Na2CO3.10H2O,溶液浓度不变,且溶质仍然为Na2CO3,
A.溶液中溶质为Na2CO3且浓度不变,所以溶液碱性不变,故A错误;
B.阳极反应式为4OH--4e-=O2↑+2H2O,故B错误;
C.溶液中溶质为Na2CO3且浓度不变,所以不影响碳酸根离子水解程度,故C正确;
D.电解析出的物质是氢气和氧气且有部分Na2CO3.10H2O晶体析出,所以加入甲酸不能恢复原状,故D错误;
故选C.
点评 本题考查电解原理、盐类水解等知识点,为高频考点,明确离子放电顺序是解本题关键,注意电解过程中发生的反应,题目难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
3.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,16gCH4含有10NA个电子 | |
| B. | 0.1mol•L-1的盐酸溶液中含有0.1NA个H+ | |
| C. | 1molNa与乙醇完全反应,失去2NA个电子 | |
| D. | 标准状况下,22.4L苯含有NA个苯分子 |
20.CCUS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化,产生经济效益.
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=-820kJ/mol
CO(g)+H2O(g)═CO2(g)+H2(g)△H2=-41.2kJ/mol
2CO(g)+O2(g)═2CO2(g)△H3=-566kJ/mol则反应的
CO2(g)+CH4(g)═2CO(g)+2H2(g)△H=+229.6kJ/mol
(2)工业上,可利用太阳能以CO2为原料制取C,其原理如图1所示:整个过程中FeO(填“Fe3O4”或“FeO”)是反应的催化剂.重整系统中发生的反应为:6FeO+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4+C每生成1mol Fe3O4,转移电子的物质的量为2mol.
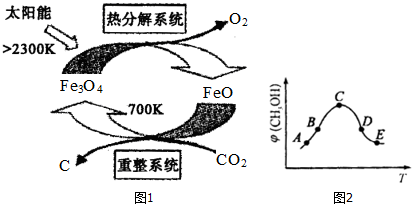
(3)CO2还可用于合成甲醇,反应方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
①该反应的平衡常数表达式为K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$.
②在恒容的密闭容器中,加入H2和CO2的混合气体,不同温度条件,反应相同时间后,测得甲醇的体积分数(CH3OH)如图2所示.图中A、B、C、D、E五个点对应的状态中,处于平衡状态的是C、D、E(填字母),B点和E点的反应速率大小关系为v(B)<v(E)(填“>”、“<”、“=”).
③一定温度下,在甲、乙两个容积相同的恒容密闭容器中,加入H2和CO2的混合气体.
甲容器平衡后气体的压强为开始时的80%,要使乙容器达平衡时与甲容器达到相同的平衡状态,且起始时反应逆向进行,则c的取值范围为0.4<n(c)≤1mol.
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=-820kJ/mol
CO(g)+H2O(g)═CO2(g)+H2(g)△H2=-41.2kJ/mol
2CO(g)+O2(g)═2CO2(g)△H3=-566kJ/mol则反应的
CO2(g)+CH4(g)═2CO(g)+2H2(g)△H=+229.6kJ/mol
(2)工业上,可利用太阳能以CO2为原料制取C,其原理如图1所示:整个过程中FeO(填“Fe3O4”或“FeO”)是反应的催化剂.重整系统中发生的反应为:6FeO+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4+C每生成1mol Fe3O4,转移电子的物质的量为2mol.

(3)CO2还可用于合成甲醇,反应方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
①该反应的平衡常数表达式为K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$.
②在恒容的密闭容器中,加入H2和CO2的混合气体,不同温度条件,反应相同时间后,测得甲醇的体积分数(CH3OH)如图2所示.图中A、B、C、D、E五个点对应的状态中,处于平衡状态的是C、D、E(填字母),B点和E点的反应速率大小关系为v(B)<v(E)(填“>”、“<”、“=”).
③一定温度下,在甲、乙两个容积相同的恒容密闭容器中,加入H2和CO2的混合气体.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) |
17.A、B、C、D是四种短周期元素,它们的原子序数依次增大.其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示:
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物.请填写下列空白:
(1)丙物质的化学式为NaH,丁物质中阴离子与阳离子的个数之比为1:2.
(2)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为H2O2?H++HO2-.
(3)某同学设计了一个以结构简式为 BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图1:
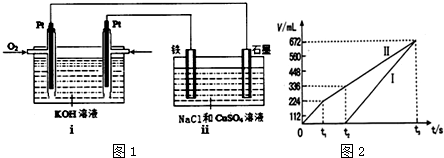
①写出ⅰ中通入该物质这一极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图2所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式2 H2O-4e-=O2↑+4 H+;;原混合液中CuSO4溶液物质的量浓度为0.1 mol/L.
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
(1)丙物质的化学式为NaH,丁物质中阴离子与阳离子的个数之比为1:2.
(2)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为H2O2?H++HO2-.
(3)某同学设计了一个以结构简式为 BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图1:

①写出ⅰ中通入该物质这一极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图2所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式2 H2O-4e-=O2↑+4 H+;;原混合液中CuSO4溶液物质的量浓度为0.1 mol/L.
4.不能证明某溶液中含有Fe2+的是( )
| A. | 该溶液呈浅绿色 | |
| B. | 该溶液中加入NaOH溶液,生成白色沉淀并迅速变成灰绿色,最后变为红褐色 | |
| C. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| D. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色 |