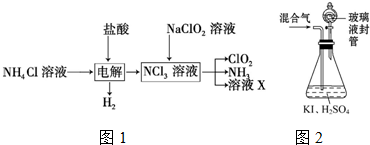
题目内容
1.下列物质不水解的是②③;水解呈酸性的是⑤;水解呈碱性的是④⑥.①FeS ②NaI ③NaHS04 ④KF ⑤NH4NO3 ⑥C17H35COONa.
分析 强酸强碱盐不发生水解,强酸弱碱盐水解显酸性,强碱弱酸盐水解显碱性,据此分析.
解答 解:①FeS难溶于水;
②NaI属于强酸强碱盐,在溶液中不水解,溶液显中性;
③NaHS04 属于强酸的酸式盐,在溶液中电离出氢离子显酸性,不水解;
④KF属于强碱弱酸盐,在溶液中水解显碱性;
⑤NH4NO3 属于强酸弱碱盐,在溶液中水解显酸性;
⑥C17H35COONa强碱弱酸盐,在溶液中水解显碱性;
所以不水解的是②③;水解显酸性的是⑤;水解显碱性的是④⑥;
故答案为:②③;⑤;④⑥.
点评 本题考查了盐的水解原理的应用,题目难度不大,侧重于基础知识的应用的考查,理解盐类水解实质是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列表示化学反应的离子方程式,其中正确的是( )
| A. | NH4HSO3溶液与足量NaOH溶液共热:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+SO32-+2H2O | |
| B. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 用盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2 MnO4-+6H++5H2O2═2Mn2++5 O2↑+8H2O | |
| D. | 用石墨电极电解饱和MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- |
12.保持温度不变,用惰性电极电解足量饱和的Na2CO3溶液,一段时间后下列叙述正确的是( )
| A. | Na2CO3溶液的碱性增强 | |
| B. | 阳极反应:CO32--2e-+H2O═CO2↑+2OH- | |
| C. | 溶液中CO32-+H2O?HCO3-+OH-平衡不移动 | |
| D. | 向溶液中加入一定量HCOOH的能复原 |
9.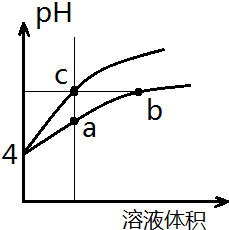 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、c两点溶液的导电能力相同 | |
| B. | b点溶液中c(H+)=c(OH-)+c(NH3•H2O) | |
| C. | a、b、c三点溶液水的电离程度a>b>c | |
| D. | 用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
6.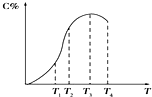 有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
 有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )| A. | 温度为T2时该反应达到平衡 | |
| B. | 该反应为吸热反应 | |
| C. | 温度为T4时,v正<v逆 | |
| D. | 温度为 T3 T4时,该反应都处于平衡状态 |
13.铜和镁的合金4.7克完全溶于浓硝酸中,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已经折算成标准状况).在反应后的溶液中加入足量的NaOH溶液,生成沉淀的质量为( )
| A. | 9.02g | B. | 8.26g | C. | 8.61g | D. | 7.04g |
11.下列说法正确的是( )
| A. | BaSO4难溶于水,但BaSO4是电解质 | |
| B. | 铜和石墨均能导电,所以它们都是电解质 | |
| C. | 电解质一定能导电,能导电的物质不一定属于电解质 | |
| D. | 液态HCl不导电,所以HCl不是电解质 |