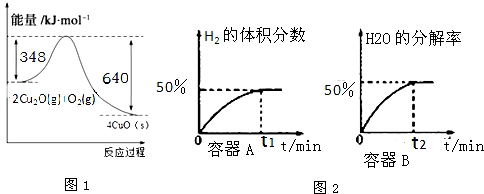
题目内容
16.关于吸热反应和放热反应,下列说法中错误的是( )| A. | 需要加热才能进行的化学反应一定是吸热反应 | |
| B. | 化学反应能量变化,除热量,还可以是光能、电能等 | |
| C. | 化学反应过程中的能量变化,也服从能量守恒定律 | |
| D. | 反应物总能量高于生成物的总能量时,发生放热反应 |
分析 化学反应总伴随着能量变化,化学能可转化为热能、光能、电能等,化学反应遵循能量守恒和质量守恒,反应物、生成物的总能量决定反应的吸放热,以此解答该题.
解答 解:A.需要加热才能进行的化学反应不一定是吸热反应,如铝热反应,需要加热,但属于放热反应,故A错误;
B.化学反应中的能量变化除了热量外还可以是光能、电能等,如燃烧发光、放热,原电池还可以转换成电能,故B正确;
C.化学反应过程中的能量变化服从能量守恒定律,质量上服从质量守恒定律,故C正确;
D.反应物总能量高于生成物的总能量时,为放热反应,释放出能量,故D正确.
故选A.
点评 本题考查化学反应与能量变化,为高频考点,侧重于学生的分析能力的考查,注意相关概念的理解,把握反应热与焓变的相关规律,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸,又名草酸,是二元弱酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间.
①需要用硫酸来酸化KMnO4溶液(填字母)A.硫酸 B.盐酸 C.硝酸
褪色所需时间tA<tB(填“>”、“=”或“<”).
②写出该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol/LKMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管,进行滴定操作.
当反应中生成的锰离子具有催化作用,所以随后褪色会加快,当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化,证明达到滴定终点.
③计算:再重复上述操作2次,记录实验数据如下:
已知H2C2O4的相对分子质量为90,则此样品的纯度为90.00%.
④误差分析:下列操作会导致测定结果偏高的是ACD.
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.
①需要用硫酸来酸化KMnO4溶液(填字母)A.硫酸 B.盐酸 C.硝酸
褪色所需时间tA<tB(填“>”、“=”或“<”).
②写出该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol/LKMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管,进行滴定操作.
当反应中生成的锰离子具有催化作用,所以随后褪色会加快,当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化,证明达到滴定终点.
③计算:再重复上述操作2次,记录实验数据如下:
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
④误差分析:下列操作会导致测定结果偏高的是ACD.
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.
7. 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
操作如下:
①在50mL圆底烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填“a”或“b”)端管口通入.
(2)进行分液操作时,使用的漏斗是C(填选项).
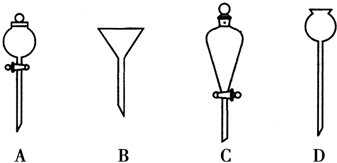
(3)仪器A中乙酸和正丁醇制备乙酸正丁酯的化学方程为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)步骤①“不断分离除去反应生成的水”的目的是使用分水器分离出水,使平衡正向移动,提高反应产率.
(5)步骤②中用10% Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(6)乙酸正丁酯的产率为65%.
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | 溶解度 /(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在50mL圆底烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填“a”或“b”)端管口通入.
(2)进行分液操作时,使用的漏斗是C(填选项).

(3)仪器A中乙酸和正丁醇制备乙酸正丁酯的化学方程为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)步骤①“不断分离除去反应生成的水”的目的是使用分水器分离出水,使平衡正向移动,提高反应产率.
(5)步骤②中用10% Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(6)乙酸正丁酯的产率为65%.
11.某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)?3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%.在此平衡体系中加入1molZ(g),恒定温度条件下,在平衡后X、Y、Z的体积分数不变.下列叙述正确的是( )
| A. | 第二次平衡时,Z的浓度为0.2 mol•L-1 | |
| B. | m=3 | |
| C. | X与Y的平衡转化率之比为1:2 | |
| D. | 加入Z后平衡没移动 |
8.下列离子方程式正确的是( )
| A. | 工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+H2O | |
| B. | 向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O | |
| C. | 制备Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
5.有甲、乙两醋酸稀溶液,测得甲的pH=a,乙的pH=a+1.下列推断中正确的是( )
| A. | 物质的量浓度c(甲)=10c(乙) | |
| B. | 甲中由水电离产生的H+的物质的量浓度和乙的相等 | |
| C. | 中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲) | |
| D. | 甲中的c(OH-)为乙中c(OH-)的10倍 |