题目内容
4.请根据化学学科中的基本理论,回答下列问题: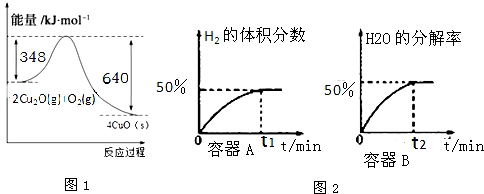
(1)纳米级的Cu2O可作为太阳光分解水的催化剂.火法还原CuO可制得Cu2O.已知:1克C(s)燃烧全部生成CO时放出热量9.2kJ;Cu2O(s)与O2(g)反应的能量变化如图1所示;请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式2CuO(s)+C(s)=CO(g)+Cu2O(s)△H=+35.6kJ•mol-1
(2)在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2和H2O.该反应的化学方程式为4Cu(OH)2+N2H4=2Cu2O+N2+6H2O
(3)某兴趣小组同学以纳米级Cu2O催化光解水蒸气并探究外界条件对化学平衡的影响.
①在体积均为1L,温度分别为T1、T2的A、B两密闭容器中都加入纳米级Cu2O并通人0.1mol水蒸气,反应:2H2O(g)?2H2(g)+O2(g)△H=+484kJ•mol-1经测定A、B两容器在反应过程中发生如图2所示变化,则A、B两容器反应的温度T1>T2(填“<”、“=”或“>”),该过程中A容器至少需要吸收能量16.1kJ.
②当该反应处于平衡状态时,下列既能增大反应速率,又能增大H2O(g)分解率的措施是(填序号)B.
A.向平衡混合物中充入Ar B.升高反应的温度
C.增大反应体系的压强 D.向平衡混合物中充人O2
(4)25℃时,H2SO3?HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh=1.0×10-12mol/L.
分析 (1)分析图象结合热化学方程式和盖斯定律解答.
(2)液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2和H2O,根据原子守恒书写化学方程式,根据电子转移数目守恒计算;
(3)①依据化学方程式结合图象中t1中氢气含量计算分析;
②既能增大反应速率,又能增大H2O(g)分解率的条件为升温,减压,依据平衡移动原理分析判断;
(4)Ka=$\frac{c(HS{{O}_{3}}^{-})c({H}^{+})}{c({H}_{2}S{O}_{3})}$,HSO3-+H2O═H2SO3+OH-,Kh=$\frac{c({H}_{2}S{O}_{3})Kw}{c(HS{{O}_{3}}^{-})c({H}^{+})}$=1.0×102×1.0×10-14=1.0×10-12.
解答 解:(1)已知:1g C(s)燃烧全部生成CO时放出热量9.2kJ;24gC燃烧生成一氧化碳放热220.8KJ,热化学方程式为:2C(s)+O2(g)=2CO(g)△H=-220.8kJ•mol-1,依据图象书写热化学方程式2Cu2O(s)+O2(g)=4CuO(s)△H=-292kJ•mol-1;
①2Cu2O(s)+O2(g)=4CuO(s)△H=-292kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H=-220.8kJ•mol-1
根据盖斯定律,②-①得4CuO(s)+2C(s)=2CO(g)+2Cu2O(s),△H=+71kJ•mol-1
即2CuO(s)+C(s)=CO(g)+Cu2O(s),△H=+35.6kJ•mol-1
故答案为:2CuO(s)+C(s)=CO(g)+Cu2O(s)△H=+35.6kJ•mol-1;
(2)用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2和H2O,反应的化学方程式为:4Cu(OH)2+N2H4=2Cu2O+N2+6H2O,
故答案为:4Cu(OH)2+N2H4=2Cu2O+N2+6H2O;
(3)①依据化学方程式计算;依据图象中氢气百分含量为50%,设反应的水的物质的量为x
2H2O(g)$\frac{\underline{\;光照\;}}{Cu_{2}O}$2H2(g)+O2 △H=484kJ•mol-1
2mol 484kJ
x x 0.5x $\frac{484x}{2}$KJ
$\frac{x}{0.1mol-x+x+0.5x}$×100%=50%,
计算得到x=$\frac{1}{15}$mol;反应吸热=$\frac{\frac{1}{15}×484KJ}{2}$=16.1kJ;
水的分解率=$\frac{\frac{1}{15}}{0.1}$×100%=66.7%,和T2温度下水的分解率为50%比较,反应是吸热反应,温度越高水的分解率越大;所以T1>T2;
故答案为:>;16.1;
②既能增大反应速率,又能增大H2O(g)分解率的条件为升温,减压,依据平衡移动原理分析判断;
A.向平衡混合物中充入Ar,增大体系压强,平衡逆向进行,故A不符合;
B.反应是吸热反应,升高反应的温度,反应速率增大,平衡正向进行,水的分解率增大,故B符合;
C.反应是气体体积增大的反应,增大反应体系的压强,平衡逆向进行,故C不符合;
D.向平衡混合物中充人O2,平衡逆向进行,故D不符合;
故答案为:B;
(4)25℃时,H2SO3═HSO3-+H+的电离常数Ka=1×10-2mol/L,Ka=$\frac{c(HS{{O}_{3}}^{-})c({H}^{+})}{c({H}_{2}S{O}_{3})}$,HSO3-+H2O?H2SO3+OH-,Kh=$\frac{c({H}_{2}S{O}_{3})Kw}{c(HS{{O}_{3}}^{-})c({H}^{+})}$=1.0×102×1.0×10-14=1.0×10-12,则该温度下NaHSO3的水解平衡常数Kh=1.0×10-12;
故答案为:1.0×10-12.
点评 本题考查较为综合,为高考常见题型,侧重于学生的分析、计算能力的考查,题目涉及热化学方程式的书写方法和盖斯定律的计算应用,化学平衡影响因素分析判断,水解常数与电离平衡常数的计算,注意平衡建立的条件分析应用,题目难度中等.

CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在同温度下反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器②中反应的平衡常数K=1.
(4)下列叙述正确的是a(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=4/Vt1mol/(L•min)
(5)已知:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,
写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)﹦2CO2(g)△H=-566 kJ/mol.
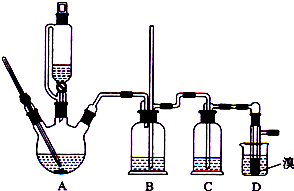
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)写出该实验过程中发生的所有主要反应的化学方程式CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2=CH2+Br-Br→CH2Br-CH2Br.
(2)在此制各实验中,要尽可能迅速地把反应温度170℃左右,其最主要目的是d.(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去(填实验现象).
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层
(6)若产物中有少量未反应的Br2,最好用b洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚.可用蒸馏的方法除去.
(8)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
(1))CO(g)+2H2(g)?CH3OH(g)△H1
(2)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
(3)CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C═O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)反应①的化学平衡常数K表达式为K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$.
| A. | 需要加热才能进行的化学反应一定是吸热反应 | |
| B. | 化学反应能量变化,除热量,还可以是光能、电能等 | |
| C. | 化学反应过程中的能量变化,也服从能量守恒定律 | |
| D. | 反应物总能量高于生成物的总能量时,发生放热反应 |
 已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A. | 如图中的两种酸分别和等浓度的NaOH溶液刚好完全反应,消耗碱的体积相等 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | a、b、c三点所示溶液中水的电离程度c>a>b | |
| D. | 图象中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a |