题目内容
1.向Fe(NO3)2溶液中逐滴加入稀盐酸,溶液颜色变化应该是( )| A. | 无变化 | B. | 颜色变浅 | C. | 变为棕黄色 | D. | 变为红褐色 |
分析 酸性条件下硝酸根离子具有强氧化性,能将亚铁离子氧化为三价,二价铁浅绿色,三价铁为棕黄色,以此解答.
解答 解:往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,发生反应的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H20,三价铁离子为棕黄色,
故选C.
点评 本题考查了不同价态铁之间的转化,为高频考点,侧重于学生的分析能力的考查,题目难度不大,明确硝酸根离子在酸性环境下具有强的氧化性是解题关键,熟记常见金属阳离子的颜色.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下列叙述正确的是( )
| A. | 离子晶体中,只存在离子键,不可能存在其他化学键 | |
| B. | 原子晶体中,只存在共价键;稀有气体的原子能形成分子晶体 | |
| C. | NaHSO4、NaOH晶体中的阴、阳离子个数比均为1:2 | |
| D. | 晶体熔点:金刚石>食盐>干冰>冰 |
16.在某无色透明溶液中,下列离子一定能共存的是( )
| A. | H+ Cu2+ Cl- SO42- | B. | HCO3- NO3- Na+ H+ | ||
| C. | SO42- Cl-Na+ K+ | D. | Na+SO42-H+ AlO2- |
6.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 加入Al能放出H2的溶液中:NH4+,SO42-,Br-,NO3- | |
| B. | 通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ | |
| C. | 无色强酸性溶液中:Na+、Cl-、SO42-、Cu2+ | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、Fe2+、Cl-、SO42- |
10.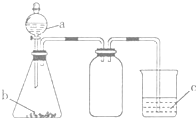 利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
 利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )| 试剂a | 试剂b | 试剂c | 实验目的 | |
| ① | 盐溶液X | NaOH | 酚酞 | 证明X中含有NH4+ |
| ② | 浓盐酸 | CaCO3 | Na2SiO3溶液 | 证明酸性: HCl>H2CO3>H2SiO3 |
| ③ | 浓盐酸 | MnO2 | 淀粉KI溶液 | 证明氧化性: MnO2>C12>I2 |
| ④ | 浓硫酸 | C | 澄清石灰水 | 证明产物中含有CO2 |
| A. | ①②③ | B. | ①③ | C. | ②③ | D. | ①②③④ |
11.浓硫酸与木炭粉在加热条件下反应.已知酸性KMnO4溶液可以吸收SO2,试用下图所示各装置设计一个实验,验证上述反应所产生的各种产物.
(1)写出木炭与浓硫酸反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.标准状况下,若生成6.72L的气体,则转移电子的物质的量为0.4mol.这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):
④→②→①→③.
(2)实验时可观察到:装置①中A瓶的溶液褪色,C瓶的溶液不褪色.B瓶溶液的作用是将多余的SO2全部氧化吸收,C瓶溶液的作用是确证产物中SO2已被B瓶溶液全部氧化.
(3)装置②中所加的固体药品是无水CuSO4,可确证的产物是水蒸气,确定装置②在整套装置中位置的理由是由于产物气流通过①、③时会带出水蒸气,所以②必须在①、③之前.
(4)盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的D
| 编号 | ① | ② | ③ | ④ |
| 装置 | 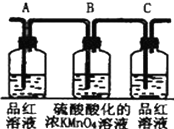 | 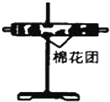 |  |  |
④→②→①→③.
(2)实验时可观察到:装置①中A瓶的溶液褪色,C瓶的溶液不褪色.B瓶溶液的作用是将多余的SO2全部氧化吸收,C瓶溶液的作用是确证产物中SO2已被B瓶溶液全部氧化.
(3)装置②中所加的固体药品是无水CuSO4,可确证的产物是水蒸气,确定装置②在整套装置中位置的理由是由于产物气流通过①、③时会带出水蒸气,所以②必须在①、③之前.
(4)盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的D

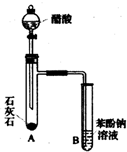 有机化合物分子中的基团之间存在着相互影响.
有机化合物分子中的基团之间存在着相互影响.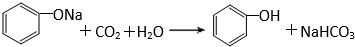 .
.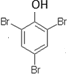 .
.