题目内容
11.浓硫酸与木炭粉在加热条件下反应.已知酸性KMnO4溶液可以吸收SO2,试用下图所示各装置设计一个实验,验证上述反应所产生的各种产物.| 编号 | ① | ② | ③ | ④ |
| 装置 | 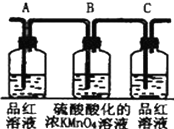 |  |  |  |
④→②→①→③.
(2)实验时可观察到:装置①中A瓶的溶液褪色,C瓶的溶液不褪色.B瓶溶液的作用是将多余的SO2全部氧化吸收,C瓶溶液的作用是确证产物中SO2已被B瓶溶液全部氧化.
(3)装置②中所加的固体药品是无水CuSO4,可确证的产物是水蒸气,确定装置②在整套装置中位置的理由是由于产物气流通过①、③时会带出水蒸气,所以②必须在①、③之前.
(4)盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的D

分析 (1)根据木炭粉与浓硫酸发生反应书写化学方程式;检验二氧化碳和二氧化硫时用到的溶液中均含有水,所以先检验水的存在,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,最后检验二氧化碳;
(2)根据实验目的和装置图考虑操作步骤和试剂的作用及发生反应,从整体考虑,A为检验二氧化硫装置,B、C为除去二氧化硫并检验是否除尽二氧化硫的装置;
(3)根据实验目的知,还要检验水蒸气,水蒸气能使无水硫酸铜变蓝,根据生成物的性质确定无水硫酸铜的位置;
(4)浓硫酸具有腐蚀性,无毒、不燃烧,结合在化学与生活中能够使用的化学物质分析解答.
解答 解:(1)根据木炭粉与浓硫酸发生反应书写化学方程式,该反应为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,若生成3mol的气体,则转移电子的物质的量为4mol,所以
标准状况下,若生成6.72L即0.3mol的气体,则转移电子的物质的量为0.4mol,检验二氧化碳和二氧化硫时用到的溶液中均含有水,所以先检验水的存在,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,最后检验二氧化碳,则其连接顺序是:④→②→①→③;
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;0.4mol;④→②→①→③;
(2)A为检验二氧化硫装置,B、C为除去二氧化硫并检验是否除尽二氧化硫的装置,
故答案为:将多余的SO2全部氧化吸收;确证产物中SO2已被B瓶溶液全部氧化;
(3)无水硫酸铜为白色固体,遇水可变为五水硫酸铜(CuSO4•5H2O)为蓝色固体,用于检验水的存在,由于产物气流通过①、③时会带出水蒸气,所以②必须在①、③之前,故答案为:无水CuSO4;水蒸气;由于产物气流通过①、③时会带出水蒸气,所以②必须在①、③之前;
(4)浓硫酸具有很强的腐蚀性,盛放浓硫酸的试剂瓶标签上应印有具有腐蚀性的标志,所以D正确.
故选D.
点评 本题考查物质的检验,注意产物检验所用的试剂以及检验的先后顺序,为易错点,难度较大.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案| A. | 无变化 | B. | 颜色变浅 | C. | 变为棕黄色 | D. | 变为红褐色 |

下列说法正确的是( )
| A. | 加热煮沸的主要目的是除去溶液中溶解的氧气 | |
| B. | 稀释过程中用到的玻璃仪器主要有烧杯、玻璃棒、胶头滴管 | |
| C. | 滴定过程中可用淀粉溶液作指示剂 | |
| D. | 铁矿石中铁的质量分数为70% |
| A. | 3 | B. | 5 | C. | 4 | D. | 2 |
| A. | 用酸性高锰酸钾溶液鉴别乙烷和乙烯 | |
| B. | 用分液漏斗分离乙醛和水 | |
| C. | 用苯、溴水和铁粉混合制取溴苯 | |
| D. | 用紫色石蕊溶液检验苯酚弱酸性 |
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |

(提示:苯甲酸甲酯粗产品往往含有少量甲醇、硫酸、苯甲酸和水等)
(1)简述第一步混合液体时,最后加入浓硫酸的理由是浓硫酸密度较大,且易于苯甲酸、甲醇混合放出大量热量,甲醇易挥发.若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式
 .
.(2)反应物CH3OH应过量,理由是该反应是可逆反应,增加甲醇的量,使平衡向右移动,有利于提高苯甲酸的转化率.
(3)分液时上层液体从分液漏斗的上口出来,接受馏分时温度控制在199.6℃左右.
(4)以上流程图中加入Na2CO3的作用是通过反应消耗硫酸、苯甲酸,降低苯甲酸甲酯的溶解度.
(5)通过计算,苯甲酸甲酯的产率为65%.
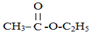 相关物质间转化关系如图:
相关物质间转化关系如图: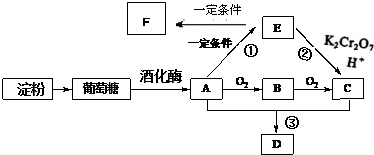
 +CH2CH2OH$?_{△}^{浓硫酸}$
+CH2CH2OH$?_{△}^{浓硫酸}$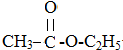 +H2O
+H2O

 .
. .
. .
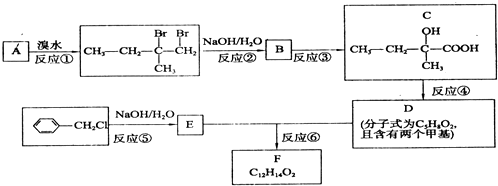
.
 .
. 铁在自然界分布广泛,在工业、农业和国防科技中有重要应用.回答下列问题:
铁在自然界分布广泛,在工业、农业和国防科技中有重要应用.回答下列问题: