题目内容
12.C、Si、Ge、Sn都是IVA族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:(1)Ge的原子核外电子排布式为1s22s22p63s23p63d104s24p2.
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是Sn.
(3)CO2分子的空间构型及碳氧之间的成键方式直线形、共价键;
(4)1molSiO2晶体中的硅氧键数目为4mol;
(5)CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为配位键.
(6)碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度B(填字母)
(A)强 (B)弱 (C)相等 (D)无法判断.
分析 (1)Ge原子核外电子数为14+18=32,结合能量最低原理书写核外电子排布式;
(2)Sn是金属,形成金属晶体;
(3)①根据价层电子对互斥理论确定其空间构型,非金属元素之间易形成共价键;
(4)二氧化硅是原子晶体,每个硅原子和4个氧原子之间形成4个共价键,每个氧原子和2个硅原子形成2个共价键;
(5)含有空轨道和孤电子对的原子之间易形成配位键;
(6)碳氧键的红外伸缩振动频率与键的强度成正比.
解答 解:(1)Ge原子核外电子数为14+18=32,根据构造原理可知核外电子排布式为1s22s22p63s23p63d104s24p2,
故答案为:1s22s22p63s23p63d104s24p2;
(2)金属元素能形成金属晶体,所以能形成金属晶体的是Sn,
故答案为:Sn;
(3)二氧化碳分子中碳原子价层电子对数是2,且不含孤电子对,所以其空间构型是直线形,碳原子和氧原子之间存在共价键,
故答案为:直线形,共价键;
(4)二氧化硅是原子晶体,每个硅原子和4个氧原子之间形成4个共价键,1molSiO2晶体中的硅氧键数目为4mol,
故答案为:4mol;
(5)Ni原子中含有空轨道、CO中含有孤电子对,所以二者能形成配位键,
故答案为:配位键;
(6)Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,碳氧键的红外伸缩振动频率与键的强度成正比,则Ni(CO)4中碳氧键的强度与CO分子中碳氧键的强度弱,
故选:B.
点评 本题考查物质结构和性质,涉及核外电子排布、晶体类型与结构、空间构型、化学键、配位键等,比较基础,注意识记中学常见晶体结构.

练习册系列答案
相关题目
3.(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;
在不同温度时K1、K2的值如表:
①反应CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数为K,则△H==△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
②能判断CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是BC(填序号).
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.将体积比为1:2的CO2、H2气体置于密闭容器中发生上述反应,CO和H2O的体积比保持不变时.
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;
在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
②能判断CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是BC(填序号).
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.将体积比为1:2的CO2、H2气体置于密闭容器中发生上述反应,CO和H2O的体积比保持不变时.
20.某原子的价电子构型为3s23p2,其核外电子运动说法错误的是( )
| A. | 有4种不同的伸展方向 | B. | 有5种不同能量的电子 | ||
| C. | 有5种不同的运动范围 | D. | 有14种不同运动状态的电子 |
7.已知2SO2(g)+O2(g)?2SO3(g),起始时SO2和O2分别为20mol和10mol,达到平衡时SO2的转化率为80%.若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为( )
| A. | 10mol 10% | B. | 20mol 20% | C. | 20mol 40% | D. | 30mol 80% |
17.对于4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g),试回答有关的问题:为了提高生成SO2的速率,可以采用的措施是( )
| A. | 增加FeS2的量 | B. | 增大O2的浓度 | C. | 升高温度 | D. | 减小压强 |
1.向Fe(NO3)2溶液中逐滴加入稀盐酸,溶液颜色变化应该是( )
| A. | 无变化 | B. | 颜色变浅 | C. | 变为棕黄色 | D. | 变为红褐色 |
2.某兴趣小组进行铁矿石中含铁量的测定,实验过程如图:

下列说法正确的是( )

下列说法正确的是( )
| A. | 加热煮沸的主要目的是除去溶液中溶解的氧气 | |
| B. | 稀释过程中用到的玻璃仪器主要有烧杯、玻璃棒、胶头滴管 | |
| C. | 滴定过程中可用淀粉溶液作指示剂 | |
| D. | 铁矿石中铁的质量分数为70% |
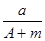 (A-N+m)mol B.
(A-N+m)mol B. 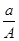 (A-N)mol
(A-N)mol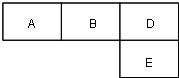 M、A、B、D、N、E五种短周期元素的原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在如图(周期表的一部分)占有相应的位置,它们的原子序数之和为37.
M、A、B、D、N、E五种短周期元素的原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在如图(周期表的一部分)占有相应的位置,它们的原子序数之和为37.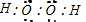 .
.