题目内容
10.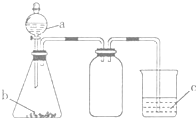 利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )| 试剂a | 试剂b | 试剂c | 实验目的 | |
| ① | 盐溶液X | NaOH | 酚酞 | 证明X中含有NH4+ |
| ② | 浓盐酸 | CaCO3 | Na2SiO3溶液 | 证明酸性: HCl>H2CO3>H2SiO3 |
| ③ | 浓盐酸 | MnO2 | 淀粉KI溶液 | 证明氧化性: MnO2>C12>I2 |
| ④ | 浓硫酸 | C | 澄清石灰水 | 证明产物中含有CO2 |
| A. | ①②③ | B. | ①③ | C. | ②③ | D. | ①②③④ |
分析 ①铵根离子和NaOH反应生成一水合氨,加热时生成氨气,氨气的水溶液呈碱性,酚酞遇碱变红色;
②盐酸和碳酸钙反应生成二氧化碳,且该反应是放热反应,浓盐酸具有挥发性,导致生成的二氧化碳中含有氯化氢,HCl能和硅酸钠反应生成硅酸;
③加热条件下,浓盐酸和二氧化锰反应生成氯气,氯气能氧化碘离子生成碘,碘遇淀粉试液变蓝色;
④加热条件下,浓硫酸和C反应生成二氧化碳和二氧化硫,二者都能和澄清石灰水反应生成白色沉淀.
解答 解:①铵根离子和NaOH反应生成一水合氨,加热时生成氨气,氨气的水溶液呈碱性,酚酞遇碱变红色,则该实验能实现实验目的,故正确;
②盐酸和碳酸钙反应生成二氧化碳,且该反应是放热反应,浓盐酸具有挥发性,导致生成的二氧化碳中含有氯化氢,HCl能和硅酸钠反应生成硅酸,所以HCl对二氧化碳的检验造成干扰,应该先除去氯化氢再通入硅酸钠溶液中,故错误;
③加热条件下,浓盐酸和二氧化锰反应生成氯气,氯气能氧化碘离子生成碘,碘遇淀粉试液变蓝色,从而判断氧化性MnO2>C12>I2,该实验能实现实验目的,故正确;
④加热条件下,浓硫酸和C反应生成二氧化碳和二氧化硫,二者都能和澄清石灰水反应生成白色沉淀,所以不能检验二氧化碳,故错误;
故选B.
点评 本题考查化学实验评价,为高频考点,涉及离子检验、气体检验、氧化性强弱比较、酸性强弱比较等知识点,明确实验原理及物质性质差异性是解本题关键,注意:离子或物质检验时要排除其它因素的干扰,题目难度不大.

练习册系列答案
相关题目
20.某原子的价电子构型为3s23p2,其核外电子运动说法错误的是( )
| A. | 有4种不同的伸展方向 | B. | 有5种不同能量的电子 | ||
| C. | 有5种不同的运动范围 | D. | 有14种不同运动状态的电子 |
1.向Fe(NO3)2溶液中逐滴加入稀盐酸,溶液颜色变化应该是( )
| A. | 无变化 | B. | 颜色变浅 | C. | 变为棕黄色 | D. | 变为红褐色 |
18.下表是五种短周期的原子半径及主要化合价.
已知铍的原子半径为0.089nm.
(1)用元素符号标出它们在周期表中对应位置(以下为周期表的一部分).
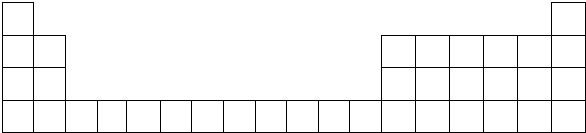
(2)B元素在元素周期表中的第三 周期IIIA 族;
(3)上述五种元素最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)A、D形成化合物的电子式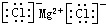 ;
;
(5)C、E形成化合物为SO2或SO3(填化学式),含化学键类型为共价键(填“离子键”或“共价键”).
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
(1)用元素符号标出它们在周期表中对应位置(以下为周期表的一部分).

(2)B元素在元素周期表中的第三 周期IIIA 族;
(3)上述五种元素最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)A、D形成化合物的电子式
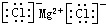 ;
;(5)C、E形成化合物为SO2或SO3(填化学式),含化学键类型为共价键(填“离子键”或“共价键”).
5.相对分子质量均为88的饱和一元醇和饱和一元羧酸发生酯化反应,生成酯的结构可能有(不考虑立体异构)( )
| A. | 8种 | B. | 12种 | C. | 16种 | D. | 32种 |
2.某兴趣小组进行铁矿石中含铁量的测定,实验过程如图:

下列说法正确的是( )

下列说法正确的是( )
| A. | 加热煮沸的主要目的是除去溶液中溶解的氧气 | |
| B. | 稀释过程中用到的玻璃仪器主要有烧杯、玻璃棒、胶头滴管 | |
| C. | 滴定过程中可用淀粉溶液作指示剂 | |
| D. | 铁矿石中铁的质量分数为70% |
19.丁烷的一氯代物共有多少种( )
| A. | 3 | B. | 5 | C. | 4 | D. | 2 |
 铁在自然界分布广泛,在工业、农业和国防科技中有重要应用.回答下列问题:
铁在自然界分布广泛,在工业、农业和国防科技中有重要应用.回答下列问题: