��Ŀ����
11����ʵ�����У����������������Ҫ�ɷ�NO2��NO��������NaOH��Һ�����գ��Գ�ȥ��Щ����������Ҫ��ӦΪ��2NO2+2NaOH�TNaNO2+NaNO3+H2O
NO+NO2+2NaOH�T2NaNO2+H2O
��1��NO��NO2�Ļ���������ɿɱ�ʾΪNOX���û������ͨ��NaOH��Һ����ȫ����ʱ��x��ֵ����Ϊcd�����ţ���
a��1.1 b��1.2 c��1.5 d��1.8
���ô�����Һ�������������������Ӧ���������ƣ�ͬʱ�ų�CO2��
��2����д��������Һ����NO2�Ļ�ѧ����ʽ2NO2+Na2CO3=NaNO2+NaNO3+CO2 ��
��3�����б�״����a��NO2������N2O4�������Ϊ20%����b��NO�Ļ����ǡ�ñ�200mL Na2CO3��Һ��ȫ�գ���a��bӦ����Ĺ�ϵΪ��$\frac{a}{b}$��$\frac{5}{6}$��
��4�����ڱ�״���£�2.016L��������Ļ������0.896LO2��1mol/LNa2CO3��Һ50mLǡ�÷�Ӧ����NaNO3������������N2O4��NO2�������Ϊ1��5��
���� ��1���ɷ���ʽ2NO2+2NaOH=NaNO2+NaNO3+H2O��NO+NO2+2NaOH=2NaNO2+H2O��֪��NO�������ܱ����գ�NO��NO2������屻NaOH��Һ����ȫ���գ�����n��NO2����n��NO����1����n��NO2����n��NO��=1ʱxֵ��С������x����Сֵ����Ϊ����NO������x���ֵ��2���ݴ�ȷ��xȡֵ��Χ��
��2��������Һ�������������������Ӧ���������ƣ�ͬʱ�ų�CO2�����Զ���������̼���Ʒ�Ӧ����NaNO2��NaNO3��CO2��
��3��������Ӧ2NO2+Na2CO3=NaNO2+NaNO3+CO2��NO2+NO+Na2CO3=2NaNO2+CO2���ӷ�Ӧʽ�Ϳ��Կ�����n��NO2��/n��NO����1����N2O4�ۻ���NO2������a��b�Ĺ�ϵ��
��4����2.016 L���������к�N2O4 x mol��NO2y mol��NO z mol���ֱ��������������ʵ����������غ㡢�����ӵ�ԭ���غ���ʽ��⣮
��� �⣺��1���ɷ���ʽ��֪��NO�������ܱ����գ�NO��NO2������屻NaOH��Һ����ȫ���գ�����n��NO2����n��NO����1����n��NO2����n��NO��=1ʱxֵ��С��x��СֵΪ=1.5����Ϊ����NO������x���ֵ��2����x��ȡֵ��ΧΪ1.5��x��2��
��ѡ��cd��
��2������������̼���Ʒ�Ӧ����NaNO2��NaNO3��CO2����Ӧ����ʽΪ��2NO2+Na2CO3=NaNO2+NaNO3+CO2 ��
�ʴ�Ϊ��2NO2+Na2CO3=NaNO2+NaNO3+CO2 ��
��3��������ӦΪ��2NO2+Na2CO3=NaNO2+NaNO3+CO2 ��NO2+NO+Na2CO3=2NaNO2+CO2���ӷ�Ӧʽ�Ϳ��Կ�����n��NO2��/n��NO����1�������ȫ����Ӧ�ˣ�
aLNO2������N2O4�����������20%����N2O4�ۻ���NO2��NO2������ܹ�ΪaL����1-20%��+aL��20%��2=1.2aL��
���ԣ�$\frac{1.2aL}{bL}$��1��$\frac{a}{b}$��$\frac{5}{6}$��
�ʴ�Ϊ��$\frac{a}{b}$��$\frac{5}{6}$��
��4���裺2.016 L���������к�N2O4 x mol��NO2 y mol��NO z mol��
x+y+z=$\frac{2.016L}{22.4L}$=0.09
2x+y+3z=$\frac{0.896L}{22.4L/mol}$��4 ����ʧ�����غ㣩
2x+y+z=0.05��2 ����ԭ�����غ㡢�������غ㣩
��ã�x=0.01��y=0.05��z=0.03��
����V��N2O4����V��NO2��=n��N2O4����n��NO2��=0.01��0.05=1��5��
�𣺻��������N2O4��NO2�������Ϊ1��5��
���� ���⿼���˵�������������ʡ�����ﷴӦ�ļ��㣬��Ŀ�Ѷ��еȣ���ȷ������Ӧ��ԭ��Ϊ���ؼ���ע���������յ�������������ʼ�Ӧ�÷���������������ѧ���ķ�����������ѧ����������

| A�� | �۵㣺HI��HBr | B�� | Ӳ�ȣ�MgO��CaO | ||
| C�� | �����ܣ�NaCl��NaBr | D�� | �۷е㣺CO2��NaCl |
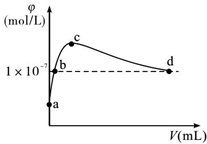 �����£���CO2ͨ��2LpH=12��KOH��Һ�У���Һ��ˮ�������OH-����Ũ�ȣ��գ���ͨ���CO2�������V���Ĺ�ϵ��ͼ��ʾ��������������ȷ���ǣ�������
�����£���CO2ͨ��2LpH=12��KOH��Һ�У���Һ��ˮ�������OH-����Ũ�ȣ��գ���ͨ���CO2�������V���Ĺ�ϵ��ͼ��ʾ��������������ȷ���ǣ�������| A�� | a����Һ�У�ˮ�������c��H+��=1��10-12mol/L | |
| B�� | b����Һ�У�c��H+��=1��10-7mol/L | |
| C�� | c����Һ�У�c��K+��=2[c��CO${\;}_{3}^{2-}$��+c��HCO3-��+c��H2CO3��] | |
| D�� | d����Һ�У�c��K+��=2c��CO${\;}_{3}^{2-}$��+c��HCO${\;}_{3}^{-}$�� |
| A�� | ��1mol��̼��ع����л����μӺ�1 mol���ʵ�ϡ��������1mol��CO2���� | |
| B�� | ��״���£���64g ͭƬͶ�뵽�� 2 molH2SO4��Ũ�����м��Ȼ����22.4 L��SO2���� | |
| C�� | ��״���£���һ���������ĸ�����ƿ����Ȫʵ�飬��ˮ����������ƿ������Һ�����磩����ƿ�ڰ�ˮ�����ʵ���Ũ��Ϊ��$\frac{1}{22.4}$��mol/L | |
| D�� | ����1mol Ba��OH��2��Һ��ͨ������CO2�������1mol BaCO3��ɫ���� |
| A�� | NO2��BF3��NCl3������û��һ��������ԭ�ӵ��������Ӷ�������8�����ȶ��ṹ | |
| B�� | P4��CH4����������������Ҽ��Ƕ�Ϊ109��28�� | |
| C�� | NaCl��������ÿ��Na+��������������Na+����8�� | |
| D�� | ���־���ͷǾ������ѧ�ķ����ǶԹ������Xһ��������ʵ�� |

 $\stackrel{Br_{2}/P}{��}$
$\stackrel{Br_{2}/P}{��}$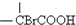
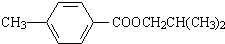 ��
��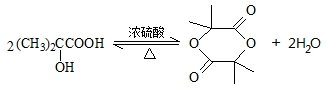 ���÷�Ӧ����������Ӧ���Ӧ���ͣ���
���÷�Ӧ����������Ӧ���Ӧ���ͣ���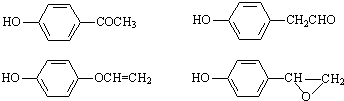 ��
�� ���ṹ��
���ṹ��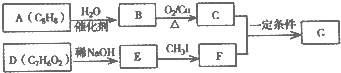
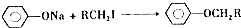

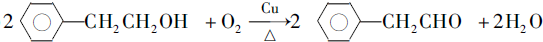 ��
�� ��
��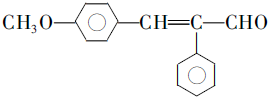 ��
��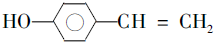 ��д�ṹ��ʽ����
��д�ṹ��ʽ����