题目内容
19.下列关系的表述中,正确的是( )| A. | 0.1mol•L-1 NaHSO3溶液中:c(Na+)+c(H+)═2c(SO32-)+c(HSO3-)+c(OH-) | |
| B. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| C. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离出的c(H+)不相等 | |
| D. | 0.1mol•L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
分析 A.根据亚硫酸氢钠溶液中的电荷守恒分析;
B.醋酸为弱酸,醋酸的浓度大于盐酸,则中和时醋酸消耗的氢氧化钠的物质的量较大;
C.盐酸抑制了水的电离,而氯化铁溶液中铁离子水解,促进了水的电离;
D.碳酸氢钠溶液呈碱性,说明碳酸氢根离子的电离程度大于其水解程度,则c(H2CO3)>c(CO32-).
解答 解:A.根据NaHSO3溶液中的电荷守恒可得:c(Na+)+c(H+)═2c(SO32-)+c(HSO3-)+c(OH-),故A正确;
B.中和pH和体积都相同的盐酸和醋酸,由于醋酸为弱酸,则醋酸的浓度大于盐酸,用氢氧化钠溶液中和等体积的两溶液时,醋酸消耗的氢氧化钠的物质的量较大,故B错误;
C.pH=3的盐酸和pH=3的FeCl3溶液中,盐酸中氢离子抑制了水的电离,而铁离子水解促进了水的电离,所以两溶液中水电离出的氢离子浓度不相等,故C错误;
D.NaHCO3溶液呈碱性,碳酸氢根离子的电离程度大于其水解程度,则c(H2CO3)>c(CO32-),溶液中正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理的含义为解答关键,C为易错点,注意掌握酸碱溶液及能够水解的盐溶液对水的电离的影响,试题培养了学生的灵活应用能力.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
18.下列化学用语正确的是( )
| A. | 葡萄糖的结构简式:C6H12O6 | B. | 中子数为8的碳原子:${\;}_{8}^{14}$C | ||
| C. | Na2O2的电子式: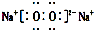 | D. | Cl-离子的结构示意图: |
7.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 25℃,1.01×105Pa,64g SO2中含有的原子数为3NA | |
| B. | 足量Fe与1 mol Cl2反应,转移了3NA个电子 | |
| C. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,11.2L H2O含有的分子数为0.5NA |
14.反应3X(g)+Y(g)?Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为( )
| A. | V(Y)=0.02mol•L-1•min-1 | B. | V(Z)=0.10mol•L-1•min-1 | ||
| C. | V(X)=0.03mol•L-1•min-1 | D. | V(W)=0.02mol•L-1•s-1 |
4.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法不正确的是( )


| A. | 简单离子半径的大小顺序g>h>e>f | |
| B. | 与x 形成化合物的沸点:d>z>y | |
| C. | zh3中各原子均满足8电子结构 | |
| D. | x、y、z、d四种元素各自最高价和最低价代数和分别为0、0、2、4 |
8.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 一定温度下,1L0.50mol/LNH4NO3溶液中含氮原子个数为NA | |
| C. | 过氧化氢分解制得标准状况下1.12LO2,转移电子数目为0.2NA | |
| D. | 28g分子式为CnH2n的链烃中含有的C-H键的数目为2NA |
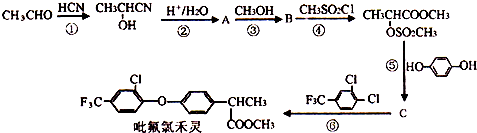
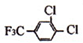 +
+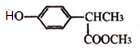 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$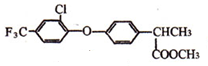 +HCl.
+HCl. .
.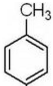 制备高分子化合物
制备高分子化合物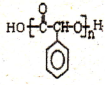 的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}}$CH2═CH2$→_{催化剂△}^{H_{2}}$CH3CH3.
的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}}$CH2═CH2$→_{催化剂△}^{H_{2}}$CH3CH3.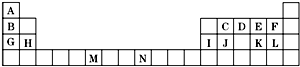 如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.