题目内容
11.毗氟氯禾灵的合成路线如图: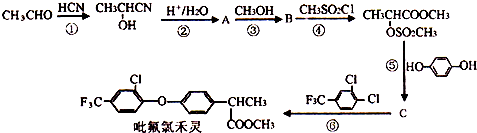
已知:RCN$\stackrel{H-/H_{2}O}{→}$RCOOH
(1)B的结构简式为CH3CH(OH)COOCH3.A的系统名称为2-羟基丙酸.
(2)在合成吡氟氯禾灵所涉及的反应中,属于加成反应的有①(填序号).
(3)写出反应⑥的化学方程式
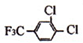 +
+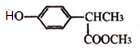 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$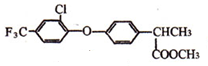 +HCl.
+HCl.(4)C的同分异构体有多种,写出同时具有下列性质的同分异构体的结构简式
 .
.a.能与FeCl3溶液发生显色反应 b.能发生银镜反应 c.核磁共振氢谱图中有四组峰
(5)写出由
 制备高分子化合物
制备高分子化合物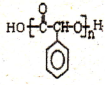 的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}}$CH2═CH2$→_{催化剂△}^{H_{2}}$CH3CH3.
的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}}$CH2═CH2$→_{催化剂△}^{H_{2}}$CH3CH3.
分析 乙醛与HCN发生加成反应生成CH3CH(OH)CN,由反应信息可知,CH3CH(OH)CN在酸性条件下发生水解反应生成A为CH3CH(OH)COOH,A与CH3OH发生正反应生成B为CH3CH(OH)COOCH3.反应④为取代反应,C与 反应生成毗氟氯禾灵,结合毗氟氯禾灵的结构及生成C的反应物可知,反应⑤属于取代反应,则C的结构简式为
反应生成毗氟氯禾灵,结合毗氟氯禾灵的结构及生成C的反应物可知,反应⑤属于取代反应,则C的结构简式为 .
.
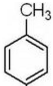
(5)甲苯与氯气在光照条件下发生取代反应生成 ,然后发生水解反应生成
,然后发生水解反应生成 ,再发生催化氧化生成
,再发生催化氧化生成 ,苯甲醛与HCN发生加成反应生成
,苯甲醛与HCN发生加成反应生成 ,酸性条件下水解得到
,酸性条件下水解得到 ,最后发生缩聚反应得到
,最后发生缩聚反应得到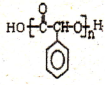 .
.
解答 解:乙醛与HCN发生加成反应生成CH3CH(OH)CN,由反应信息可知,CH3CH(OH)CN在酸性条件下发生水解反应生成A为CH3CH(OH)COOH,A与CH3OH发生正反应生成B为CH3CH(OH)COOCH3.反应④为取代反应,C与 反应生成毗氟氯禾灵,结合毗氟氯禾灵的结构及生成C的反应物可知,反应⑤属于取代反应,则C的结构简式为
反应生成毗氟氯禾灵,结合毗氟氯禾灵的结构及生成C的反应物可知,反应⑤属于取代反应,则C的结构简式为 .
.
(1)B的结构简式为CH3CH(OH)COOCH3,A为CH3CH(OH)COOH,A的系统名称为2-羟基丙酸,
故答案为:CH3CH(OH)COOCH3;2-羟基丙酸;
(2)在合成吡氟氯禾灵所涉及的反应中,反应①属于加成反应,反应②属于水解反应,反应③④⑤⑥属于取代反应,
故答案为:①;
(3)反反应⑥是 与
与 发生取代反应生成
发生取代反应生成 ,反应方程式为:
,反应方程式为: +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +HCl,
+HCl,
故答案为: +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +HCl;
+HCl;
(4)C的结构简式为 ,C的同分异构体同时具有下列性质:a.能与FeCl3溶液发生显色反应,说明含有酚羟基,b.能发生银镜反应,说明含有醛基,c.核磁共振氢谱图中有四组峰,符合条件的同分异构体为:
,C的同分异构体同时具有下列性质:a.能与FeCl3溶液发生显色反应,说明含有酚羟基,b.能发生银镜反应,说明含有醛基,c.核磁共振氢谱图中有四组峰,符合条件的同分异构体为: ,
,
故答案为: ;
;
(5)甲苯与氯气在光照条件下发生取代反应生成 ,然后发生水解反应生成
,然后发生水解反应生成 ,再发生催化氧化生成
,再发生催化氧化生成 ,苯甲醛与HCN发生加成反应生成
,苯甲醛与HCN发生加成反应生成 ,酸性条件下水解得到
,酸性条件下水解得到 ,最后发生缩聚反应得到
,最后发生缩聚反应得到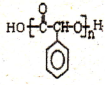 ,合成路线流程图为:
,合成路线流程图为: ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成、有机反应类型、限制条件同分异构体的书写等,熟练掌握官能团的性质与转化,注意(4)中同分异构体的书写为易错点、难点.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案| 装置 | 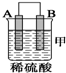 | 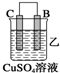 | 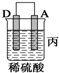 |
| 现象 | 金属A不 断溶解 | C的质 量增加 | A上有气 体产生 |
①装置甲中作正极的是B (填“A”或“B”).
②装置乙溶液中Cu2+向C极移动(填“B”或“C”).
③装置丙中金属A上电极反应属于还原反应(填“氧化反应”或“还原反应”).
④四种金属活动性由强到弱的顺序是D>A>B>C.
| A. | 0.1mol•L-1 NaHSO3溶液中:c(Na+)+c(H+)═2c(SO32-)+c(HSO3-)+c(OH-) | |
| B. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| C. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离出的c(H+)不相等 | |
| D. | 0.1mol•L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
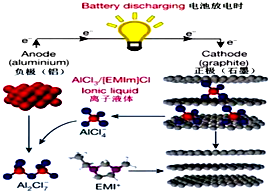 据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )
据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )| A. | 放电时,铝电极的电极反应式为:Al+7AlCl4--3e-═4Al2Cl7- | |
| B. | [EMIm]Cl中既含离子键,又含共价键 | |
| C. | 电子流向为:石墨通过离子液体流向铝 | |
| D. | 充电时石墨电极的电极反应式为:Cn[AlCl4]-e-═Cn+AlCl4- |
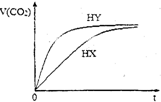 25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )| A. | 相同浓度的HX和HY溶液中水的电离程度:HX>HY | |
| B. | 相同体积相同浓度的HX和HY溶液中阴离子数目前者大于后者 | |
| C. | 向10mL 0.1mol•L-1的Na2CO3溶液中缓慢滴加10mL0.1mol•L-1的HY,混合后的离子浓度大小关系: c (Na+)>c (Y-)>c(HCO3-)>c (OH-)>c(H+) | |
| D. | 将等体积等浓度的HX和HY溶液分别用相同浓度的氢氧化钠溶液滴定,至中性时,消耗的氢氧化钠溶液体积前者大于后者 |
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.98 | 20.02 | 19.00 |
(2)上述过程中涉及的反应:①2Fe3++2I-═2Fe2++I2②6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)根据滴定有关数据,该废液中I-含量是15.24g•L-1.
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是A.
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡.
Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.某学习小组同学设计如下实验:
| 实验编号 | 实验操作 | 现象 |
| 1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
| 2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
| 3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
(5)设计实验①的目的是排除NO3-的干扰.
(6)实验③可得出结论是Fe3+能氧化Ag.
(7)写出实验②中反应的离子方程式Fe2++Ag+?Fe3++Ag.
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子浓度有关.
| A. | 10min内,Y的平均反应速率为0.03 mol•L-1•min-1 | |
| B. | 第10min时,X的反应速率为0.01 mol•L-1•min-1 | |
| C. | 10min内,消耗0.1 mol X,生成0.4 mol Z | |
| D. | 10min内,X和Y反应放出的热量为a kJ |
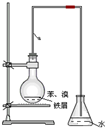 某同学设计如图装置制取少量溴苯,请回答下列问题:
某同学设计如图装置制取少量溴苯,请回答下列问题: .
.