题目内容
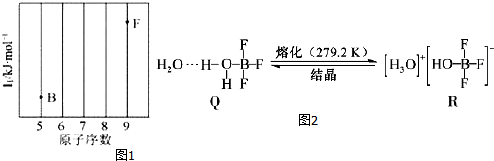
4.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法不正确的是( )
| A. | 简单离子半径的大小顺序g>h>e>f | |
| B. | 与x 形成化合物的沸点:d>z>y | |
| C. | zh3中各原子均满足8电子结构 | |
| D. | x、y、z、d四种元素各自最高价和最低价代数和分别为0、0、2、4 |
分析 从图中的化合价、原子半径的大小及原子序数可知:x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,
A.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
B.常温下,水为液体,甲烷、氨气为气体,水的沸点最高,氨气分子之间存在氢键,沸点比甲烷的高;
C.zh3为NCl3,N、Cl原子最外层均满足8电子稳定结构;
D.x是H元素,y是C元素,z是N元素,d是O元素,其中O元素没有最高正化合价.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,
A.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->Cl->Na+>Al3+,即g>h>e>f,故A正确;
B.常温下,水为液体,甲烷、氨气为气体,水的沸点最高,氨气分子之间存在氢键,沸点高于甲烷的,则与x 形成化合物的沸点:d>z>y,故B正确;
C.zh3为NCl3,N、Cl原子之间形成了3对共用电子对,则N、Cl元素都满足8电子稳定结构,故C正确;
D.x、y、z、d分别为H、C、N、O元素,H、C元素最高价和最低价代数和为0,N元素最高价为+5,最低价为-3,则最高价和最低价代数和为+2,而O没有+6价,则最高价和最低价代数和不可能为2,故D错误;
故选D.
点评 本题考查结构性质位置关系应用,题目难度中等,根据化合价与原子半径推断元素是解题关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,D为易错点,注意O元素没有最高化合价,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
3.下列说法中,正确的是( )
| A. | 糖类、蛋白质、橡胶、油脂都是天然高分子化合物 | |
| B. | 加热会使蛋白质变性,因此食生鸡蛋所获营养价值高 | |
| C. | 通过灼烧时产生的气味可以鉴别蚕丝和棉纱 | |
| D. | 检验淀粉在稀硫酸催化下水解程度的方法是:取适量水解液于试管中,加入少量碘水,若出现蓝色说明没有水解 |
4.下列物质中既可通过氧化还原反应生成,又可通过复分解反应生成的是( )
| A. | Al2S3 | B. | SO2 | C. | H2SiO3 | D. | NO2 |
12.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,可依次通过盛有下列哪一组试剂的洗气瓶( )
| A. | 澄清石灰水、浓H2SO4 | B. | 酸性KMnO4溶液、浓H2SO4 | ||
| C. | 溴水、浓H2SO4 | D. | 浓H2SO4、NaOH溶液 |
19.下列关系的表述中,正确的是( )
| A. | 0.1mol•L-1 NaHSO3溶液中:c(Na+)+c(H+)═2c(SO32-)+c(HSO3-)+c(OH-) | |
| B. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| C. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离出的c(H+)不相等 | |
| D. | 0.1mol•L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
9.现代生活需要提升我们的科学素养,以下说法科学的是( )
| A. | 某护肤品广告宣称产品不含任何化学成分 | |
| B. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| C. | 日用铝制品表面不用刷漆防腐蚀 | |
| D. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素而产生的 |
14.用CuSO4•5H2O配制0.1mol/L的水溶液,下列方法正确的是( )
| A. | 取25gCuSO4•5H2O溶于1L水中 | |
| B. | 将CuSO4•5H2O干燥去掉结晶水,取16g溶于水制成1L溶液 | |
| C. | 将25gCuSO4•5H2O溶于水制成1L溶液 | |
| D. | 将12.5gCuSO4•5H2O溶于500mL水中 |
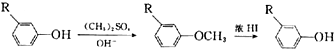
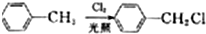
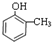 ;E→F的反应类型为取代反应;
;E→F的反应类型为取代反应;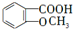 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$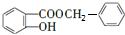 +HCl;
+HCl;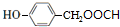 (写结构简式).
(写结构简式). 和(CH2)3CCl为起始原料制备
和(CH2)3CCl为起始原料制备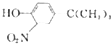 的合成路线
的合成路线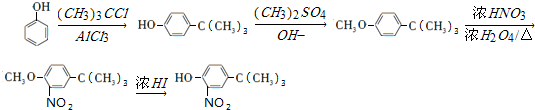 .
.