题目内容
9.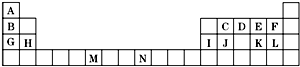 如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.试回答下列问题:
(1)请写出元素N的基态原子电子排布式1s22s22p63s23p63d74s2或[Ar]3d74s2.
(2)元素B、G形成的单质熔点更高的是Li(填化学式),原因是Li和Na的价电子数相同,但Li的原子半径小于Na的原子半径,所以Li的金属键更强,熔点更高.
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是非极性(填“极性”或“非极性”)分子.根据等电子原理:NO2+中氮原子的杂化类型是sp.1mol O22+中含有π键的数目为2NA.
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有①③(填序号),CS2分子的空间构型是直线型.
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为[Co(NH3)5SO4]Br.
分析 由元素在周期表的位置可知,A为H,B为Li,C为C,D为N,E为O,F为F,G为Na,H为Mg,I为Al,J为Si,K为S,L为Cl,M为Cr,N为Co,
(1)N的原子序数序数为27;
(2)碱金属的熔点从上到下减小,与原子半径有关;
(3)能与CCl4、CS2等互溶,为分子晶体的性质;NO2+中氮原子的成键电子对为2,孤对电子为$\frac{5-1-2×2}{2}$=0;O22+的电子式  ,在1个O22+含有2个π键;
,在1个O22+含有2个π键;
(4)碳原子采取sp2杂化的分子,为平面结构,CS2分子的结构为S=C=S;
(5)若加入AgNO3溶液时,产生淡黄色沉淀,则溴离子为外界离子.
解答 解:由元素在周期表的位置可知,A为H,B为Li,C为C,D为N,E为O,F为F,G为Na,H为Mg,I为Al,J为Si,K为S,L为Cl,M为Cr,N为Co,
(1)元素N的基态原子电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2,故答案为:1s22s22p63s23p63d74s2或[Ar]3d74s2;
(2)元素B、G形成的单质熔点更高的是Li,原因是Li和Na的价电子数相同,但Li的原子半径小于Na的原子半径,所以Li的金属键更强,熔点更高,
故答案为:Li;Li和Na的价电子数相同,但Li的原子半径小于Na的原子半径,所以Li的金属键更强,熔点更高;
(3)能与CCl4、CS2等互溶,为分子晶体的性质,由相似相溶可知,为非极性分子;NO2+中氮原子的成键电子对为2,孤对电子为$\frac{5-1-2×2}{2}$=0,则N原子为sp杂化;O22+的电子式  ,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个π键,
,在1个O22+含有2个π键,故1 mol O22+中,含有2NA个π键,
故答案为:非极性;sp;2NA;
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有①③,④为sp杂化,②⑤为sp3杂化,CS2分子的结构为S=C=S,空间结构为直线型,故答案为:①③;直线型;
(5)若加入AgNO3溶液时,产生淡黄色沉淀,则溴离子为外界离子,配位数为6,则化学式为[Co(NH3)5SO4]Br,故答案为:[Co(NH3)5SO4]Br.
点评 本题考查位置、结构与性质及原子结构等,为高频考点,把握元素的位置、性质、杂化理论及配合物等为解答的关键,侧重分析与应用能力的考查,注意原子结构与性质的应用,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 0.1mol•L-1 NaHSO3溶液中:c(Na+)+c(H+)═2c(SO32-)+c(HSO3-)+c(OH-) | |
| B. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| C. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离出的c(H+)不相等 | |
| D. | 0.1mol•L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.98 | 20.02 | 19.00 |
(2)上述过程中涉及的反应:①2Fe3++2I-═2Fe2++I2②6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)根据滴定有关数据,该废液中I-含量是15.24g•L-1.
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是A.
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡.
Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.某学习小组同学设计如下实验:
| 实验编号 | 实验操作 | 现象 |
| 1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
| 2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
| 3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
(5)设计实验①的目的是排除NO3-的干扰.
(6)实验③可得出结论是Fe3+能氧化Ag.
(7)写出实验②中反应的离子方程式Fe2++Ag+?Fe3++Ag.
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子浓度有关.
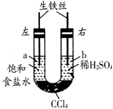 如图在盛有CCl4的U形管左右两端分别加入饱和食盐水和稀硫酸,使两边液面相平,再塞上插有铁丝的塞子,密封好,放置一段时间.下列说法错误的是( )
如图在盛有CCl4的U形管左右两端分别加入饱和食盐水和稀硫酸,使两边液面相平,再塞上插有铁丝的塞子,密封好,放置一段时间.下列说法错误的是( )| A. | 左右两边铁丝腐蚀速率一样快 | B. | 左右两边负极反应均为Fe-2e→Fe2+ | ||
| C. | 左边液面高于右边液面 | D. | 左右两边溶液的pH均升高 |
| A. | 等浓度时,若溶液中c(X-)=c(Y-)+c(HY),则乙的pH大 | |
| B. | 等浓度时,若甲的pH大,则甲中总离子浓度大 | |
| C. | 甲浓度大时,若溶液中c(X-)=c(Y-),则甲中水的电离程度大 | |
| D. | 乙浓度大时,若酸性HX强,则乙的水解程度大 |
| A. | 取25gCuSO4•5H2O溶于1L水中 | |
| B. | 将CuSO4•5H2O干燥去掉结晶水,取16g溶于水制成1L溶液 | |
| C. | 将25gCuSO4•5H2O溶于水制成1L溶液 | |
| D. | 将12.5gCuSO4•5H2O溶于500mL水中 |
| A. | 10min内,Y的平均反应速率为0.03 mol•L-1•min-1 | |
| B. | 第10min时,X的反应速率为0.01 mol•L-1•min-1 | |
| C. | 10min内,消耗0.1 mol X,生成0.4 mol Z | |
| D. | 10min内,X和Y反应放出的热量为a kJ |
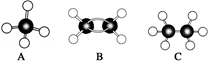 现有A、B、C三种烃,其球棍模型图:
现有A、B、C三种烃,其球棍模型图: