题目内容
14.反应3X(g)+Y(g)?Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为( )| A. | V(Y)=0.02mol•L-1•min-1 | B. | V(Z)=0.10mol•L-1•min-1 | ||
| C. | V(X)=0.03mol•L-1•min-1 | D. | V(W)=0.02mol•L-1•s-1 |
分析 2L密闭容器中进行,5min后Y减少了0.1mol,v(Y)=$\frac{\frac{0.1mol}{2L}}{5min}$=0.01mol•L-1•min-1,结合反应速率之比等于化学计量数之比计算.
解答 解:2L密闭容器中进行,5min后Y减少了0.1mol,v(Y)=$\frac{\frac{0.1mol}{2L}}{5min}$=0.01mol•L-1•min-1,
由反应速率之比等于化学计量数之比可知,
v(Y)=v(Z)=0.01mol•L-1•min-1,
V(X)=0.01mol•L-1•min-1×3=0.03mol•L-1•min-1,
V(W)=0.01mol•L-1•min-1×2=0.02mol•L-1•min-1,
故选C.
点评 本题考查化学反应速率与化学计算数关系,为高频考点,把握反应速率的计算公式、反应速率与化学计量数的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1molFeCl2与1molCl2反应时转移的电子数为2NA | |
| B. | 2g H218O与D216O的混合物中所含电子数目为NA | |
| C. | 273K,101kPa下,28g乙烯与丙烯混合物中含有C-H键的数目为5NA | |
| D. | pH=1的H2SO3溶液10L,含H+的数目为2NA |
14.可用于鉴别以下三种化合物的试剂组合是( )
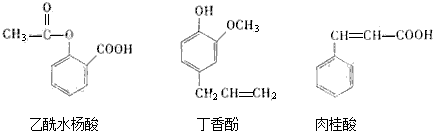
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④碳酸钠溶液.

①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④碳酸钠溶液.
| A. | ②与③ | B. | ③与④ | C. | ①与④ | D. | ②与④ |
9.下列有关电解质溶液的说法正确的是( )
| A. | pH相同的 ①CH3COOK ②KHCO3 ③KClO三种溶液的c(K+):①>②>③ | |
| B. | 0.1mol/L NaHC2O4溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(C2O42-)>c(HC2O4- )>c(OH-)>c(H+) | |
| C. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)═c(H+)+c(HS-)+c(H2S) | |
| D. | 向0.2 mol•L-1的氨水中加入少量氯化铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
19.下列关系的表述中,正确的是( )
| A. | 0.1mol•L-1 NaHSO3溶液中:c(Na+)+c(H+)═2c(SO32-)+c(HSO3-)+c(OH-) | |
| B. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| C. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离出的c(H+)不相等 | |
| D. | 0.1mol•L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
6.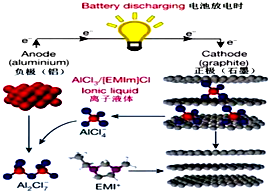 据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )
据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )
 据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )
据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )| A. | 放电时,铝电极的电极反应式为:Al+7AlCl4--3e-═4Al2Cl7- | |
| B. | [EMIm]Cl中既含离子键,又含共价键 | |
| C. | 电子流向为:石墨通过离子液体流向铝 | |
| D. | 充电时石墨电极的电极反应式为:Cn[AlCl4]-e-═Cn+AlCl4- |
3.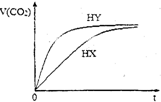 25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
 25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )| A. | 相同浓度的HX和HY溶液中水的电离程度:HX>HY | |
| B. | 相同体积相同浓度的HX和HY溶液中阴离子数目前者大于后者 | |
| C. | 向10mL 0.1mol•L-1的Na2CO3溶液中缓慢滴加10mL0.1mol•L-1的HY,混合后的离子浓度大小关系: c (Na+)>c (Y-)>c(HCO3-)>c (OH-)>c(H+) | |
| D. | 将等体积等浓度的HX和HY溶液分别用相同浓度的氢氧化钠溶液滴定,至中性时,消耗的氢氧化钠溶液体积前者大于后者 |
4.室温下甲为NaX溶液、乙为NaY溶液,两者均为一元酸的钠盐.下列分析正确的是( )
| A. | 等浓度时,若溶液中c(X-)=c(Y-)+c(HY),则乙的pH大 | |
| B. | 等浓度时,若甲的pH大,则甲中总离子浓度大 | |
| C. | 甲浓度大时,若溶液中c(X-)=c(Y-),则甲中水的电离程度大 | |
| D. | 乙浓度大时,若酸性HX强,则乙的水解程度大 |
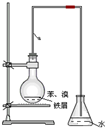 某同学设计如图装置制取少量溴苯,请回答下列问题:
某同学设计如图装置制取少量溴苯,请回答下列问题: .
.