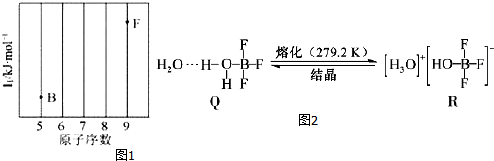
题目内容
8.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 一定温度下,1L0.50mol/LNH4NO3溶液中含氮原子个数为NA | |
| C. | 过氧化氢分解制得标准状况下1.12LO2,转移电子数目为0.2NA | |
| D. | 28g分子式为CnH2n的链烃中含有的C-H键的数目为2NA |
分析 A.NO2和N2O4之间存在转化,方程式2NO2?N2O4;
B.1mol硝酸铵中含有2mol氮原子;
C.过氧化氢分解制得O2,每生成1molO2转移2mol电子;
D.CnH2n最简式CH2,含有2个C-H键.
解答 解:A.NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,2molNO与1molO2恰好完全反应生成2molNO2,但NO2和N2O4之间存在转化,方程式2NO2?N2O4,所以产物分子数小于2NA,故A错误;
B.一定温度下,1L0.50mol/LNH4NO3溶液,含有硝酸铵物质的量为0.50mol/L×1L=0.50mol,含有氮原子物质的量为0.50mol×2=1.0mol,个数为NA,故B正确;
C.过氧化氢分解制得O2,每生成1molO2转移2mol电子,制得标准状况下1.12L O2,物质的量为0.05mol,故应为0.1NA,故C错误;
D.28g分子式为CnH2n的链烃,含有CH2结构单元$\frac{28g}{14g/mol}$=2mol,含有C-H键的数目为4NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算和应用,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量之间的转化是解题关键,注意过氧化氢中氧元素化合价为-1价,题目难度不大.

练习册系列答案
相关题目
19.下列关系的表述中,正确的是( )
| A. | 0.1mol•L-1 NaHSO3溶液中:c(Na+)+c(H+)═2c(SO32-)+c(HSO3-)+c(OH-) | |
| B. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| C. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离出的c(H+)不相等 | |
| D. | 0.1mol•L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
3.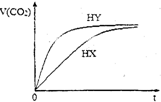 25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
 25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )| A. | 相同浓度的HX和HY溶液中水的电离程度:HX>HY | |
| B. | 相同体积相同浓度的HX和HY溶液中阴离子数目前者大于后者 | |
| C. | 向10mL 0.1mol•L-1的Na2CO3溶液中缓慢滴加10mL0.1mol•L-1的HY,混合后的离子浓度大小关系: c (Na+)>c (Y-)>c(HCO3-)>c (OH-)>c(H+) | |
| D. | 将等体积等浓度的HX和HY溶液分别用相同浓度的氢氧化钠溶液滴定,至中性时,消耗的氢氧化钠溶液体积前者大于后者 |
20.Ⅰ.Fe3+具有氧化性,实验室测定含碘废液中I-的含量的过程如下:量取25.00mL废液于250mL锥形瓶中,分别加入5mL 2mol•L-1 H2SO4和10mL 20% Fe2(SO4)3溶液,摇匀.小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500mol•L-1标准K2Cr2O7溶液进行滴定到终点.重复3次,数据记录如表:
(1)在盛有废液的锥形瓶中先加入5mL 2mol•L-1 H2SO4的目的是Fe3++3H2O?Fe(OH)3+3H+,加入H2SO4平衡逆向移动,抑制Fe3+水解.(用离子方程式和语言叙述解释)
(2)上述过程中涉及的反应:①2Fe3++2I-═2Fe2++I2②6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)根据滴定有关数据,该废液中I-含量是15.24g•L-1.
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是A.
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡.
Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.某学习小组同学设计如下实验:
请回答:
(5)设计实验①的目的是排除NO3-的干扰.
(6)实验③可得出结论是Fe3+能氧化Ag.
(7)写出实验②中反应的离子方程式Fe2++Ag+?Fe3++Ag.
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子浓度有关.
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.98 | 20.02 | 19.00 |
(2)上述过程中涉及的反应:①2Fe3++2I-═2Fe2++I2②6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)根据滴定有关数据,该废液中I-含量是15.24g•L-1.
(4)在滴定过程中,下列操作(其他操作正确)会造成测定结果偏低的是A.
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗衣后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡.
Ⅱ.Fe3+和Ag+的氧化性相对强弱一直是实验探究的热点.某学习小组同学设计如下实验:
| 实验编号 | 实验操作 | 现象 |
| 1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
| 2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
| 3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
(5)设计实验①的目的是排除NO3-的干扰.
(6)实验③可得出结论是Fe3+能氧化Ag.
(7)写出实验②中反应的离子方程式Fe2++Ag+?Fe3++Ag.
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子浓度有关.
17.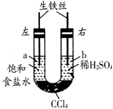 如图在盛有CCl4的U形管左右两端分别加入饱和食盐水和稀硫酸,使两边液面相平,再塞上插有铁丝的塞子,密封好,放置一段时间.下列说法错误的是( )
如图在盛有CCl4的U形管左右两端分别加入饱和食盐水和稀硫酸,使两边液面相平,再塞上插有铁丝的塞子,密封好,放置一段时间.下列说法错误的是( )
 如图在盛有CCl4的U形管左右两端分别加入饱和食盐水和稀硫酸,使两边液面相平,再塞上插有铁丝的塞子,密封好,放置一段时间.下列说法错误的是( )
如图在盛有CCl4的U形管左右两端分别加入饱和食盐水和稀硫酸,使两边液面相平,再塞上插有铁丝的塞子,密封好,放置一段时间.下列说法错误的是( )| A. | 左右两边铁丝腐蚀速率一样快 | B. | 左右两边负极反应均为Fe-2e→Fe2+ | ||
| C. | 左边液面高于右边液面 | D. | 左右两边溶液的pH均升高 |
 .
.
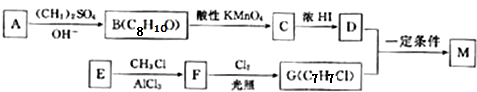
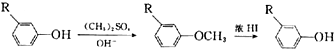
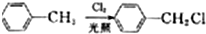
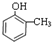 ;E→F的反应类型为取代反应;
;E→F的反应类型为取代反应;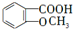 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$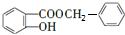 +HCl;
+HCl;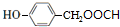 (写结构简式).
(写结构简式). 和(CH2)3CCl为起始原料制备
和(CH2)3CCl为起始原料制备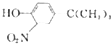 的合成路线
的合成路线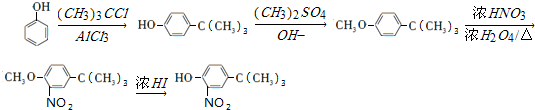 .
.