题目内容
用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A、1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、0.1 mol H2O中含有电子的数目为NA |
| C、标准状况下,11.2L四氯化碳中含有分子的数目为0.5NA |
| D、0.5 mol?L-1 CaCl2溶液中的Cl-的数目为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.1.6个氧气和臭氧的混合物中含有1.6g氧原子,含有0.1mol氧原子;
B.1个水分子中含有10个电子,据此解答;
C.气体摩尔体积只适用气体;
D.没指明体积无法计算.
B.1个水分子中含有10个电子,据此解答;
C.气体摩尔体积只适用气体;
D.没指明体积无法计算.
解答:
解:A.1.6g氧气和臭氧的混合物中含有氧原子的质量为1.6g,含有氧原子的物质的量为0.1mol,含有氧原子的数目为0.1NA,故A正确;
B.1个水分子中含有10个电子,0.1 mol H2O中含有电子的数目为NA,故B正确;
C.标准状况下,四氯化碳是液体,不能应用气体摩尔体积,故C错误;
D.依据n=CV可知,题干中没指明溶液的体积无法计算Cl-的物质的量及数目,故D错误;
故选:CD.
B.1个水分子中含有10个电子,0.1 mol H2O中含有电子的数目为NA,故B正确;
C.标准状况下,四氯化碳是液体,不能应用气体摩尔体积,故C错误;
D.依据n=CV可知,题干中没指明溶液的体积无法计算Cl-的物质的量及数目,故D错误;
故选:CD.
点评:本题考查了阿伏伽德罗常数的分析,明确物质的量、NA、微粒个数之间的转化关系是解题关键,注意气体摩尔体积的使用条件,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
不具有放射性的同位素称之为稳定同位素,稳定同位素分析法近20年来在植物生理学、生态学和环境科学研究中获得广泛应用,如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物,下列有关说法正确的是( )
| A、34S原子核内中子数为16 |
| B、1H216O和1H218O的相对分子质量相差2 |
| C、13C和15N原子的原子序数相差2 |
| D、2H+结合OH-的能力比1H+的更强 |
关于离子浓度的关系,下列说法错误的是( )
| A、等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| B、新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C、室温下,向0.01mol/LNH4HSO4 溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42->c(NH4+)>c(OH-)=c(H+) |
| D、物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,离子浓度可能的关系为:c(Na+)>c(OH-)>c(HA)>c(HB) |
下列实验错误的是( )
| A、食醋用氢氧化钠溶液滴定,开始时溶液的pH通常变化缓慢,当接近滴定终点时,pH 出现突变,称为滴定突跃 |
| B、结晶时,若沉淀的结晶颗粒较大,静置后容易沉降到容器底部,此时,进行分离的操作方法是倾析 |
| C、抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作的主要原理是抽气泵给吸滤瓶减压,导致装置内部的压强降低,使过滤的速度加快 |
| D、在纸层析法分离Fe3+和Cu2+的实验中,层析后,经氨熏,滤纸中无色带出现,一定是误将试样点浸没在展开剂中 |
下列实验不能达到目的是( )
A、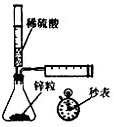 测定一定时间内生成H2的反应速率 |
B、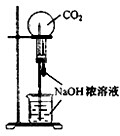 用CO2做喷泉实验 |
C、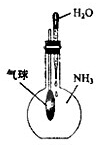 验证NH3易溶于水 |
D、 比较Na2CO3与NaHCO3的热稳定性 |
将15g金属混合物粉末投入足量稀H2SO4中,充分反应后得到11.2L H2(在标准状况下),此金属混合物可能组成是( )
| A、Zn、Ag |
| B、Cu、Fe |
| C、Al、Fe |
| D、Mg、Al |
下列各项中离子方程式的书写与反应物的用量无关的是( )
| A、AlCl3溶液与稀氨水 |
| B、FeBr2溶液与Cl2 |
| C、CO2与Na2SiO3溶液 |
| D、澄清石灰水与Ca(HCO3)2溶液 |
 (I)如图是某学校林老师制备NH3并进行性质实验时的改进装置.按图1把仪器安装好,称取2g固体氯化铵装入试管底部,再称取2g氢氧化钠覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水:把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡.
(I)如图是某学校林老师制备NH3并进行性质实验时的改进装置.按图1把仪器安装好,称取2g固体氯化铵装入试管底部,再称取2g氢氧化钠覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水:把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡.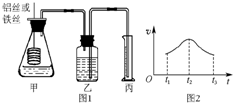 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置.
某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置.