题目内容
下列各项中离子方程式的书写与反应物的用量无关的是( )
| A、AlCl3溶液与稀氨水 |
| B、FeBr2溶液与Cl2 |
| C、CO2与Na2SiO3溶液 |
| D、澄清石灰水与Ca(HCO3)2溶液 |
考点:离子方程式的书写
专题:
分析:离子方程式的书写与反应物的用量无关,则改变反应物的用量,均发生相同的离子反应,以此来解答.
解答:
解:A.改变用量,均发生离子反应为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故A选;
B.FeBr2溶液与Cl2,氯气少量:Cl2+2Fe2+=2Fe3++2Cl-;氯气过量:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2,故B不选;
C.二氧化碳少量,生成硅酸和碳酸钠,离子反应为CO2+H2O+SiO32-=H2SiO3↓+CO32-,二氧化碳过量,生成硅酸和碳酸氢钠,离子反应为2CO2+2H2O+SiO32-=H2SiO3↓+2HCO3-,故C不选;
D.改变用量,离子反应均为Ca2++HCO3-+OH-=CaCO3↓+H2O,故D选;
故选AD.
B.FeBr2溶液与Cl2,氯气少量:Cl2+2Fe2+=2Fe3++2Cl-;氯气过量:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2,故B不选;
C.二氧化碳少量,生成硅酸和碳酸钠,离子反应为CO2+H2O+SiO32-=H2SiO3↓+CO32-,二氧化碳过量,生成硅酸和碳酸氢钠,离子反应为2CO2+2H2O+SiO32-=H2SiO3↓+2HCO3-,故C不选;
D.改变用量,离子反应均为Ca2++HCO3-+OH-=CaCO3↓+H2O,故D选;
故选AD.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应考查,题目难度不大.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A、1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、0.1 mol H2O中含有电子的数目为NA |
| C、标准状况下,11.2L四氯化碳中含有分子的数目为0.5NA |
| D、0.5 mol?L-1 CaCl2溶液中的Cl-的数目为NA |
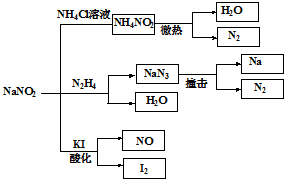 亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见如图.下列说法不正确的是( )
亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见如图.下列说法不正确的是( )| A、NH4NO2的热稳定性大于NaNO2 |
| B、NaN3分解,每产生1molN2转移6mole- |
| C、NaN3可用氨基钠(NaNH2)和N2O在液氨中低温制备,N2O与N3-互为等电子体 |
| D、可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2 |
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
T1温度下的部分实验数据为:下列说法不正确的是( )
T1温度下的部分实验数据为:下列说法不正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500s内N2O5分解速率为2.96×10-3 mol/(L?s) |
| B、T1温度下的平衡常数为K1=125,1000s时转化率为50% |
| C、其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 |
| D、T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若T1>T3,则K1>K3 |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( )


| A、30min时降低温度,40min时充入生成物C |
| B、0~8min内A的平均反应速率为0.08mol/(L?min) |
| C、反应方程式中的x=1,正反应为吸热反应 |
| D、20min~40min间该反应的平衡常数均为8 |
改变外界条件可以影响化学反应速率,对反应H2(g)+I2(g)?2HI(g),其中能使活化分子百分数增加的是:①升高体系的温度 ②增加反应物浓度 ③增大气体的压强 ④使用催化剂( )
| A、①③ | B、①④ | C、②③ | D、③④ |
下列分离、提纯、鉴别物质的方法正确的是( )
| A、用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| B、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| C、用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
| D、用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
下列推论正确的是( )
| A、H2(g)的燃烧热是285.8 kJ?mol-1,则H2O(g)=2H2(g)+O2(g)△H=+285.8 kJ?mol-1 |
| B、对于反应2H2O2═2H2O+O2↑,升高温度能加快O2的生成速率 |
| C、已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
| D、在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl-?[CuCl4]2-(绿)+4H2O,若向溶液中滴加足量AgNO3溶液,可使溶液呈现绿色 |



