题目内容
关于离子浓度的关系,下列说法错误的是( )
| A、等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| B、新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C、室温下,向0.01mol/LNH4HSO4 溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42->c(NH4+)>c(OH-)=c(H+) |
| D、物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,离子浓度可能的关系为:c(Na+)>c(OH-)>c(HA)>c(HB) |
考点:离子浓度大小的比较,盐类水解的原理
专题:盐类的水解专题
分析:A.混合液中一定满足物料守恒,根据混合液中物料守恒判断;
B.氯气与水反应生成氯化氢和次氯酸,溶液显示酸性,溶液中氢氧根离子浓度较小,则c(OH-)<c(ClO-);
C.若二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,若使溶液呈酸性,则需要再滴加少许NaOH呈中性,则:c(Na+)>c(SO42-),根据电荷守恒可知c(Na+)+c(NH4+)=2c(SO42-),则c(Na+)>c(SO42->c(NH4+);
D.当NaA和NaB都是弱酸,且酸性HA<HB,则NaA的水解程度大于NaB,水解后的溶液中满足:c(HA)>c(HB).
B.氯气与水反应生成氯化氢和次氯酸,溶液显示酸性,溶液中氢氧根离子浓度较小,则c(OH-)<c(ClO-);
C.若二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,若使溶液呈酸性,则需要再滴加少许NaOH呈中性,则:c(Na+)>c(SO42-),根据电荷守恒可知c(Na+)+c(NH4+)=2c(SO42-),则c(Na+)>c(SO42->c(NH4+);
D.当NaA和NaB都是弱酸,且酸性HA<HB,则NaA的水解程度大于NaB,水解后的溶液中满足:c(HA)>c(HB).
解答:
解:A.等浓度的NaClO、NaHCO3混合溶液中,根据物料守恒可得:c(HClO)+c(ClO-)=c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故A正确;
B.新制氯水显示酸性,且氢氧根离子非常小,溶液中离子浓度关系为:c(Cl-)>c(H+)>c(ClO-)>c(OH-),故B错误;
C.NH4HSO4中滴加NaOH溶液,若二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,溶液呈酸性,需要再滴加少许NaOH呈中性,c(Na+)+c(NH4+)=2c(SO42-),故溶液中离子浓度大小关系为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故C正确;
D.NaA和NaB若是弱酸,酸性HA<HB时,则NaA的水解程度大于NaB,水解后的溶液中:c(HA)>c(HB)、c(Na+)>c(OH-),则溶液中离子浓度大小为:c(Na+)>c(OH-)>c(HA)>c(HB),故D正确;
故选B.
B.新制氯水显示酸性,且氢氧根离子非常小,溶液中离子浓度关系为:c(Cl-)>c(H+)>c(ClO-)>c(OH-),故B错误;
C.NH4HSO4中滴加NaOH溶液,若二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,溶液呈酸性,需要再滴加少许NaOH呈中性,c(Na+)+c(NH4+)=2c(SO42-),故溶液中离子浓度大小关系为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故C正确;
D.NaA和NaB若是弱酸,酸性HA<HB时,则NaA的水解程度大于NaB,水解后的溶液中:c(HA)>c(HB)、c(Na+)>c(OH-),则溶液中离子浓度大小为:c(Na+)>c(OH-)>c(HA)>c(HB),故D正确;
故选B.
点评:本题考查了溶液中离子浓度大小比较,题目难度中等,注意熟练掌握盐的水解原理及其应用方法,明确电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用,试题考查了学生的分析、理解能力及综合应用所学知识的能力.

练习册系列答案
相关题目
小科为研究“碱与盐反应”的规律,设计了如图所示的五组实验,每支试管盛有3毫升溶液,分别向试管中滴加3滴溶液,除氢氧化钙溶液是饱和外,其余溶液的质量分数都为5%,下列叙述正确的是( )


| A、甲组和乙组实验能观察到相同的现象 |
| B、乙组和丙组实验均能观察到蓝色沉淀 |
| C、乙组实验产生的沉淀质量比丁组多 |
| D、戊组实验产生的沉淀质量比丙组少 |
在恒温时,一固定容积的容器内发生反应:PCl5(g)?PCl3 (g)+Cl2(g).达到平衡时,再向容器内通入一定量PCl5 (g),重新达到平衡后,与第一次平衡时相比,Cl2的浓度( )
| A、增大 | B、减小 |
| C、不变 | D、无法判断 |
用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A、1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、0.1 mol H2O中含有电子的数目为NA |
| C、标准状况下,11.2L四氯化碳中含有分子的数目为0.5NA |
| D、0.5 mol?L-1 CaCl2溶液中的Cl-的数目为NA |
如图表示在催化剂作用下将X和Y合成具有生物活性物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述正确的是( )
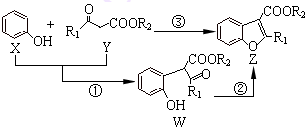

| A、反应①属于加成反应 |
| B、W中至少含有1个手性碳原子 |
| C、X、Y、W、Z这四种物质中最多有三种能与NaOH溶液反应 |
| D、可用溴水或FeCl3溶液鉴别出X和W |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( )


| A、30min时降低温度,40min时充入生成物C |
| B、0~8min内A的平均反应速率为0.08mol/(L?min) |
| C、反应方程式中的x=1,正反应为吸热反应 |
| D、20min~40min间该反应的平衡常数均为8 |


 和环状结构
和环状结构 是E的最简单的同系物.
是E的最简单的同系物.