题目内容
下列实验不能达到目的是( )
A、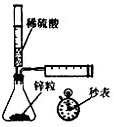 测定一定时间内生成H2的反应速率 |
B、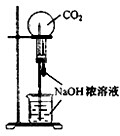 用CO2做喷泉实验 |
C、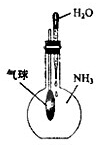 验证NH3易溶于水 |
D、 比较Na2CO3与NaHCO3的热稳定性 |
考点:化学实验方案的评价
专题:
分析:A.Zn与硫酸反应生成氢气,利用秒表测定时间,针筒测定氢气的体积;
B.二氧化碳易与NaOH反应导致气体减少;
C.氨气极易溶于水;
D.碳酸氢钠不稳定,图中不能体现对比性.
B.二氧化碳易与NaOH反应导致气体减少;
C.氨气极易溶于水;
D.碳酸氢钠不稳定,图中不能体现对比性.
解答:
解:A.Zn与硫酸反应生成氢气,利用秒表测定时间,针筒测定氢气的体积,则图中装置可测定生成氢气的速率,故A正确;
B.二氧化碳易与NaOH反应导致气体减少,则挤压胶头滴管图中可形成喷泉实验,故B正确;
C.氨气极易溶于水,则挤压胶头滴管图中气球变小可验证NH3易溶于水,故C正确;
D.碳酸氢钠不稳定,图中不能体现对比性,小试管中温度低应盛放碳酸氢钠,故D错误;
故选D.
B.二氧化碳易与NaOH反应导致气体减少,则挤压胶头滴管图中可形成喷泉实验,故B正确;
C.氨气极易溶于水,则挤压胶头滴管图中气球变小可验证NH3易溶于水,故C正确;
D.碳酸氢钠不稳定,图中不能体现对比性,小试管中温度低应盛放碳酸氢钠,故D错误;
故选D.
点评:本题考查化学实验方案的评价,为高频考点,涉及反应速率测定、气体的溶解性及喷泉实验、稳定性的比较等,把握物质的性质及反应原理为解答的关键,注意实验装置的作用及实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
在恒温时,一固定容积的容器内发生反应:PCl5(g)?PCl3 (g)+Cl2(g).达到平衡时,再向容器内通入一定量PCl5 (g),重新达到平衡后,与第一次平衡时相比,Cl2的浓度( )
| A、增大 | B、减小 |
| C、不变 | D、无法判断 |
用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A、1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、0.1 mol H2O中含有电子的数目为NA |
| C、标准状况下,11.2L四氯化碳中含有分子的数目为0.5NA |
| D、0.5 mol?L-1 CaCl2溶液中的Cl-的数目为NA |
下列各组物质的水溶液不用试剂无法鉴别出来的是( )
| A、NaOH、AlCl3 |
| B、CuSO4、BaCl2 |
| C、NaAlO2、HCl |
| D、MgCl2、AlCl3 |
如图表示在催化剂作用下将X和Y合成具有生物活性物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述正确的是( )
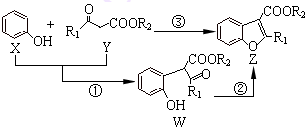

| A、反应①属于加成反应 |
| B、W中至少含有1个手性碳原子 |
| C、X、Y、W、Z这四种物质中最多有三种能与NaOH溶液反应 |
| D、可用溴水或FeCl3溶液鉴别出X和W |
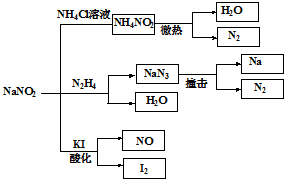 亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见如图.下列说法不正确的是( )
亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见如图.下列说法不正确的是( )| A、NH4NO2的热稳定性大于NaNO2 |
| B、NaN3分解,每产生1molN2转移6mole- |
| C、NaN3可用氨基钠(NaNH2)和N2O在液氨中低温制备,N2O与N3-互为等电子体 |
| D、可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2 |
下列分离、提纯、鉴别物质的方法正确的是( )
| A、用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| B、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| C、用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
| D、用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
