题目内容
6.苯甲醇在热的铜催化下能制得苯甲醛.可用于检验实验所获是否纯净物的方法是( )| A. | 定量分析--测沸点 | |
| B. | 定性分析--滴入酸性高锰酸钾溶液 | |
| C. | 定量分析--使用银氨溶液 | |
| D. | 定性分析--与新制氢氧化铜悬浊液共热 |
分析 A.混合物没有固体的沸点;
B.苯甲醇和苯甲醛都可使酸性高锰酸钾褪色;
C.苯甲醛发生银镜反应,-CHO~2Ag;
D.无论是否纯净,苯甲醛都可与新制氢氧化铜反应.
解答 解:A.纯净物具有固定的沸点,而混合物没有固定的沸点,可确定是否纯净物,故A正确;
B.苯甲醇和苯甲醛都可使酸性高锰酸钾褪色,则定性分析不能确定是否为纯净物,故B错误;
C.苯甲醛发生银镜反应,存在-CHO~2Ag,定量分析可确定是否为纯净物,故C正确;
D.无论是否纯净,苯甲醛都可与新制氢氧化铜反应,则定性分析不能确定为纯净物,故D错误;
故选AC.
点评 本题考查化学实验方案的评价,注意根据物质的性质判断实验方案的合理性和严密性,选项C中定量能判断,但定性不能判断,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.化工生产需要用到各种原料,其中与事实相符合的是( )
| A. | 用乙醇和浓硫酸制乙烯 | B. | 用电解水获得的氢气来合成氨 | ||
| C. | 用晒盐后的卤水制溴单质 | D. | 用氢氧化钠和二氧化碳制碳酸钠 |
1.25℃时,Kw=1.0×10-14;100℃时,Kw=5.4×10-13.对有关溶液pH说法正确的是( )
| A. | 100℃时,pH=12的NaOH(aq)和pH=2的H2SO4(aq)恰好中和,所得溶液的pH=7 | |
| B. | 100℃时,0.2 mol/L Ba(OH)2(aq)和0.2 mol/L HCl(aq)等体积混合,所得溶液的pH=7 | |
| C. | 25℃时,0.2 mol/L NaOH(aq)与0.2 mol/L CH3COOH(aq)恰好中和,所得溶液的pH=7 | |
| D. | 25℃时,pH=12的氨水和pH=2的H2SO4(aq)等体积混合,所得溶液的pH>7 |
11.用NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
| A. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA | |
| B. | 11.2mol•L-1K2S溶液中S2-和HS-的总数为2NA | |
| C. | 300ml2mol•L-1蔗糖溶液中所含分子数为0.6NA | |
| D. | 标准状况下,30g乙酸和甲醛的混合物中氧原子数为NA |
18.化学与生产、生活、环境等社会实际密切相关.下列叙述正确的是( )
| A. | “滴水石穿、绳锯木断”不涉及化学变化 | |
| B. | 明矾净水的原理和“84”消毒液消毒的原理不相同 | |
| C. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| D. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |
15.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq)$\stackrel{NaOH(aq)}{→}$Fe(OH)2 | |
| B. | Al3+$\stackrel{过量氨水}{→}$Al${\;}_{2}^{-}$$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | NH3$\stackrel{O_{2}}{→}$NO$\stackrel{H_{2}O}{→}$HNO3 | |
| D. | 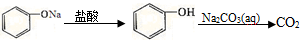 |
16.下列说法正确的是( )
| A. | 难失去电子的原子,易形成阴离子 | |
| B. | 只有化合物分子中才存在共价键 | |
| C. | 共价分子中所有原子都具有8电子稳定结构 | |
| D. | 含氧酸的组成中可以含有金属元素 |
