题目内容
1.25℃时,Kw=1.0×10-14;100℃时,Kw=5.4×10-13.对有关溶液pH说法正确的是( )| A. | 100℃时,pH=12的NaOH(aq)和pH=2的H2SO4(aq)恰好中和,所得溶液的pH=7 | |
| B. | 100℃时,0.2 mol/L Ba(OH)2(aq)和0.2 mol/L HCl(aq)等体积混合,所得溶液的pH=7 | |
| C. | 25℃时,0.2 mol/L NaOH(aq)与0.2 mol/L CH3COOH(aq)恰好中和,所得溶液的pH=7 | |
| D. | 25℃时,pH=12的氨水和pH=2的H2SO4(aq)等体积混合,所得溶液的pH>7 |
分析 A、100℃时Kw=5.4×10-13,当恰好中和时,c(H+)=c(OH-)=$3\sqrt{6}×1{0}^{-7}$mol/L;
B、100℃时Kw=5.4×10-13,0.2 mol/L Ba(OH)2(aq)和0.2 mol/L HCl(aq)等体积混合后溶液显碱性,先求出混合后溶液中的c(OH-),然后根据c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$求出c(H+),再求pH;
C、25℃时,0.2 mol/L NaOH(aq)与0.2 mol/L CH3COOH(aq)恰好中和得醋酸钠溶液;
D、25℃时,Kw=1.0×10-14,一水合氨为弱电解质,不能完全电离,而硫酸为强电解质,完全电离,据此分析混合后溶液的成分.
解答 解:A、100℃时Kw=5.4×10-13,当恰好中和时,c(H+)=c(OH-)=$3\sqrt{6}×1{0}^{-7}$mol/L,则pH小于7,故A错误;
B、100℃时Kw=5.4×10-13,0.2 mol/L Ba(OH)2(aq)中c(OH-)=0.4mol/L,0.2 mol/L HCl(aq)溶液中c(H+)=0.2mol/L,等体积混合后氢氧化钡过量,故溶液显碱性,先求出混合后溶液中的c(OH-)=$\frac{0.4mol/L×VL-0.2mol/L×VL}{2VL}$=0.1mol/L,故溶液中的c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{5.4×1{0}^{-13}}{0.1}$=5.4×10-12mol/L,故pH=12-lg5.4,故B错误;
C、25℃时,0.2 mol/L NaOH(aq)与0.2 mol/L CH3COOH(aq)恰好中和得醋酸钠溶液,由于醋酸钠为强碱弱酸盐,水解显碱性,故溶液的pH大于7,故C错误;
D、25℃时,Kw=1.0×10-14,pH=7显中性.一水合氨为弱电解质,不能完全电离,而硫酸为强电解质,完全电离,故pH=12的氨水和pH=2的H2SO4(aq)等体积混合后氨水过量,溶液显碱性,即pH大于7,故D正确.
故选D.
点评 本题考查了溶液混合后pH的相关计算,并考查了盐类的水解,综合性较强,应注意的是温度对水的离子积数值的影响.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案| A. |  | B. |  | C. |  | D. |  |
| A. | PX 项目的主要产品对二甲苯属于饱和烃 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 保护加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉 |
| A. | C3H8 | B. |  | C. | 二氯乙烷 | D. |  |
| A. | 定量分析--测沸点 | |
| B. | 定性分析--滴入酸性高锰酸钾溶液 | |
| C. | 定量分析--使用银氨溶液 | |
| D. | 定性分析--与新制氢氧化铜悬浊液共热 |
| 相关实验 | 预期目的 | |
| A | 向少量燃尽火柴头的浸泡液中滴加稀硫酸,AgNO3 | 验证火柴头含有氯元素 |
| B | 向两支装有等体积,等浓度的H2O2溶液试管中分别加入1mol等浓度的FeCl3溶液、CuSO4溶液 | 催化效果:Fe3+>Cu2+ |
| C | 向待测溶液中加NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝的气体 | 证明原溶液中含有NH4+ |
| D | 向等浓度的NaCl、KI混合液中逐滴加入AgNO3溶液先出现黄色沉淀 | K(sp),AgCl>AgI |
| A. | A | B. | B | C. | C | D. | D |
| A. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | B. | 碳原子的结构示意图: | ||
| C. | CO2分子的结构式: | D. | 聚丙烯的结构简式: |
| (1) | 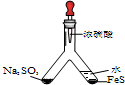 | 实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为管壁内有淡黄色固体生成;硫化亚铁处加水的目的是稀释浓硫酸,防止硫化氢被氧化. |
| (2) | 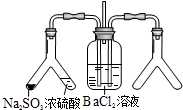 | 实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y型管中应放置的药品是浓氨水、碱石灰(固体NaOH、生石灰)(必要时可以加热),该沉淀的化学式为BaSO3. |
| (3) | 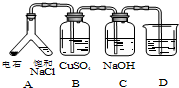 | 实验目的:探究电石气中的成分 ①装置A中的化学反应方程式为: CaC2+2H2O→Ca(OH)2+CH≡CH↑. ②B装置中出现黑色沉淀,可判断电石气中含有H2S;C装置的作用为除去硫化氢. ③为验证电石气的主要成分,D中盛放酸性高锰酸钾溶液或溴水. |
| (4) | 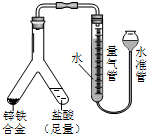 | 实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是抬高(或移动)水准管位置,使水准管、量气管内液面相平 ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的含量为69.14%(保留2位小数,已折算标况). |