题目内容
将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应,(假设容器不参加反应).若过滤后滤渣能被磁铁吸引,则下列有关叙述正确的是( )
| A、溶液中肯定不存在的离子只有Fe3+ |
| B、Fe3+和Cu2+均能被铁粉还原 |
| C、Fe2+与SCN-能形成红色的物质 |
| D、滤渣中肯定不含有铜 |
考点:铁的化学性质
专题:元素及其化合物
分析:根据FeCl3、CuCl2的氧化性强弱判断反应先后顺序,从而确定固体的成分、溶液的成分;若过滤后滤渣能被磁铁吸引,铁有剩余,一定有铜生成,三价铁离子和二价铜离子无剩余.
解答:
解:若过滤后滤渣能被磁铁吸引,说明固体为铁,溶液中的Fe3+、Cu2+全部参加反应生成Fe2+和Cu,反应的反应方程式为:2FeCl3+Fe=3FeCl2、
CuCl2+Fe=Cu+FeCl2,所以溶液中一定没有Fe3+、Cu2+,一定含有Fe2+,
故选B.
CuCl2+Fe=Cu+FeCl2,所以溶液中一定没有Fe3+、Cu2+,一定含有Fe2+,
故选B.
点评:本题考查了Fe3+、Cu2+的氧化能力大小的比较,能正确判断固体的成分是解本题的关键,根据固体的成分了解反应的先后顺序,从而确定溶液的成分.

练习册系列答案
相关题目
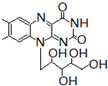 核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构如图所示:已知:
核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构如图所示:已知: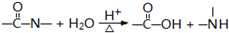
有关核黄素的下列说法中,不正确的是( )
| A、该化合物的分子式为C17H22N4O6 |
| B、酸性条件下加热水解,有CO2生成 |
| C、该分子中有3个手性碳原子(与4个不同基团连接的碳原子叫手性碳原子) |
| D、能发生酯化反应 |
现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A、在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 |
| B、温度下降10℃,四种溶液的pH均不变 |
| C、分别加水稀释10倍,四种溶液的pH:①>②>③>④ |
| D、将①、④两种溶液等体积混合,所得溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
下列叙述正确的是( )
A、乙酸的键线式是 |
B、间二甲苯 又叫2,4-二甲苯 又叫2,4-二甲苯 |
C、 的最长碳链有7个C原子 的最长碳链有7个C原子 |
D、 的名字读作:3位甲基3丁烯 的名字读作:3位甲基3丁烯 |
下列有关氯水的表述不正确的是( )
| A、向氯水中加入碳酸钙粉末,能提高溶液中HClO的浓度 |
| B、氯水中含有7种微粒,其可以与AgNO3、FeBr2等多种物质反应 |
| C、蓝色石蕊试纸放入氯水中先变红后褪色 |
| D、氯水可以导电,说明氯气是电解质 |
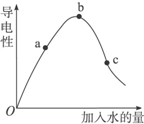 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示.请完成下列问题:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示.请完成下列问题: