题目内容
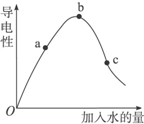 一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示.请完成下列问题:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示.请完成下列问题:(1)“O”点为什么不导电?
(2)a、b、c三点pH由大到小的顺序为
(3)25℃时,在0.5L 0.2mol?L-1的CH3COOH溶液中,有0.01mol的CH3COOH电离成离子.该温度下CH3COOH的电离平衡常数
(4)已知250C时几种物质的电离度(溶液浓度均为0.1mol/L)如下表(已知硫酸的第一步电离是完全的):
则 0.1mol/L上述几种溶液中C(H+)由大到小的顺序是
| ①H2SO4溶液 HSO4-?H++SO42- | ②NaHSO4溶液 HSO4-?H++SO42- | ③醋酸溶液 CH3COOH?H++CH3COO- | ④盐酸 HCl=H++Cl- |
| 10% | 29% | 1.33% | 100% |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强;溶液越稀,越促进醋酸电离;
(2)导电能力越强,离子浓度越大,氢离子浓度越大,pH越小;
(3)根据Ka=
计算;
(4)c(H+)=C(酸)×α(电离度),注意硫酸分两步电离
(2)导电能力越强,离子浓度越大,氢离子浓度越大,pH越小;
(3)根据Ka=
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
(4)c(H+)=C(酸)×α(电离度),注意硫酸分两步电离
解答:
解:(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸中没有自由移动的离子,所以冰醋酸不导电;溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大,所以电离程度最大的是c;
故答案为:无水不电离,无自由移动的离子;c;
(2)导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,则a、b、c三点溶液的pH为b<a<c,故答案为:b<a<c;
(3)25℃时,在0.5L 0.2mol?L-1的CH3COOH溶液中,有0.01mol的CH3COOH电离成离子,则c(H+)=c(CH3COO-)=
=0.05mol/L,
则Ka=
=
=2.22×10-3;
故答案为:2.22×10-3;
(4)硫酸第一步完全电离,第二步部分电离,硫酸中C(H+)=(0.1+0.1×10%)mol/L=0.11mol/L;
硫酸氢钠溶液中,C(H+)=(0.1×29%)mol/L=0.029mol/L;
醋酸溶液中,C(H+)=(0.1×1.33%)mol/L=0.00133mol/L;
盐酸溶液中,C(H+)=0.1mol/L;
所以C(H+)由大到小的顺序是①>④>②>③,
故答案为:①>④>②>③.
故答案为:无水不电离,无自由移动的离子;c;
(2)导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,则a、b、c三点溶液的pH为b<a<c,故答案为:b<a<c;
(3)25℃时,在0.5L 0.2mol?L-1的CH3COOH溶液中,有0.01mol的CH3COOH电离成离子,则c(H+)=c(CH3COO-)=
| 0.01mol |
| 0.5L |
则Ka=
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
| 0.05×0.05 |
| 0.2-0.05 |
故答案为:2.22×10-3;
(4)硫酸第一步完全电离,第二步部分电离,硫酸中C(H+)=(0.1+0.1×10%)mol/L=0.11mol/L;
硫酸氢钠溶液中,C(H+)=(0.1×29%)mol/L=0.029mol/L;
醋酸溶液中,C(H+)=(0.1×1.33%)mol/L=0.00133mol/L;
盐酸溶液中,C(H+)=0.1mol/L;
所以C(H+)由大到小的顺序是①>④>②>③,
故答案为:①>④>②>③.
点评:本题考查电解质的电离、电离常数的计算,题目难度中等,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
向mg镁和铝的混合物重加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL.向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng.再将得到的沉淀灼烧至质量不再改变为止,得到固体pg.则下列关系不正确的是( )
A、c=
| ||||
B、p=m+
| ||||
| C、n=m+17Vc | ||||
D、
|
将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应,(假设容器不参加反应).若过滤后滤渣能被磁铁吸引,则下列有关叙述正确的是( )
| A、溶液中肯定不存在的离子只有Fe3+ |
| B、Fe3+和Cu2+均能被铁粉还原 |
| C、Fe2+与SCN-能形成红色的物质 |
| D、滤渣中肯定不含有铜 |
某溶液中除了H+、OH-以外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子的物质的量浓度之比为1:1:6,下列有关该溶液判断正确的是( )
| A、向该溶液中加入KI溶液后,原有的5种离子的物质的量不变 |
| B、向该溶液中滴加稀NaOH溶液,立即出现白色沉淀 |
| C、向该溶液中加入过量铁粉,只发生置换反应 |
| D、若溶液中c (Cl-)=0.6mol/L,则该溶液的pH=1 |
下列物质能使品红溶液褪色,其中是利用强氧化性来漂白的是( )
①活性炭 ②过氧化钠 ③氯水 ④Al(OH)3胶体 ⑤臭氧.
①活性炭 ②过氧化钠 ③氯水 ④Al(OH)3胶体 ⑤臭氧.
| A、①③④ | B、②③⑤ |
| C、①②③④ | D、①②③④⑤ |
下列叙述正确的是( )
| A、常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
| B、Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg |
| C、HClO见光会分解,故氯水保存在棕色试剂瓶中 |
| D、Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中的Fe也显+3价 |
关于下列各图的叙述正确的是( )
A、 a、b曲线分别表示反应CH3CH3(g)→CH2=CH2(g)+H2(g)(△H>0),使用和未使用催化剂时,反应过程中的能量变化 |
B、 表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
C、 表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A |
D、 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液 |
下列关于铜电极的叙述正确的是( )
| A、铜锌原电池中铜是阳极 |
| B、用电解法精炼粗铜时纯铜作阳极 |
| C、在镀件上电镀铜时可用金属铜作阳极 |
| D、氯碱工业中用铜作阳极 |