题目内容
在标准状况下,1L水溶解一定体积的NH3,所得溶液的密度为ρ g?cm-3,物质的量浓度为a mol?L-1,则溶解的NH3的体积为多少?
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:依据物质的量浓度的计算公式,C=
,分别计算溶质的物质的量和溶液的体积.
| n |
| V |
解答:
解:设溶解氨气的体积标准状况下为V,则氨气的物质的量n=
mol;
溶液的体积V(液)=
=
×10-3L=
×10-3L
则所得溶液中溶质的物质的量浓度为=
=
=a,解得V=
;
答:溶解的NH3的体积为
.
| V |
| 22.4 |
溶液的体积V(液)=
| 溶液的质量 |
| 溶液的密度 |
| ||
| ρ |
| 17V+22400 |
| 22.4ρ |
则所得溶液中溶质的物质的量浓度为=
| n |
| V(液) |
| V | ||||
|
| 22400a |
| (1000ρ-17a) |
答:溶解的NH3的体积为
| 22400a |
| (1000ρ-17a) |
点评:本题考查了物质的量浓度计算,明确物质的量浓度的定义和计算公式是解题关键,注意溶液体积的计算方法,题目难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
等物质的量的SO2和SO3相比较,下列结论错误的是( )
| A、分子数之比为1:1 |
| B、所含原子数之比为2:3 |
| C、质量之比为1:1 |
| D、氧原子数之比为2:3 |
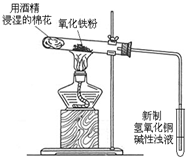 某课外小组同学做了如下探究实验:将蘸有饱和氯化铁溶液的粉笔,用坩埚钳夹持置于酒精灯火焰上灼烧,一分钟内可观察到如下颜色变化:黄色(氯化铁溶液)--红褐色(A)--铁锈红色(B)--黑色(C).
某课外小组同学做了如下探究实验:将蘸有饱和氯化铁溶液的粉笔,用坩埚钳夹持置于酒精灯火焰上灼烧,一分钟内可观察到如下颜色变化:黄色(氯化铁溶液)--红褐色(A)--铁锈红色(B)--黑色(C).