题目内容
锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患.
(1)某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如图1所示.
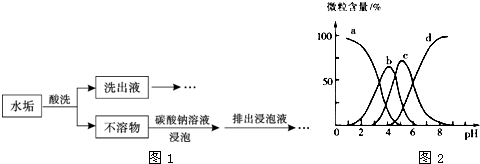
①酸洗时,为使水垢尽可能溶解,不宜选用的是 (填标号).
A.稀硫酸 B.盐酸 C.硝酸 D.醋酸
②不溶物用碳酸钠溶液浸泡时,反应的离子方程式是 .
③洗出液中的Fe3+会腐蚀铁质管道,反应的离子方程式是 ,因此,常在洗出液中加入具有强还原性的SnCl2溶液,反应中的Sn2+与Fe3+的物质的量之比为1:2,Sn2+转化为② (填离子符号).
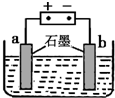
④柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图2所示.图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是 .调节柠檬酸溶液的pH=4,有利于除去水垢中的氧化铁.pH=4时,溶液中上述4种微粒含量最多的是 .
(2)利用下图所示装置对锅炉水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止锅炉水垢的形成. 电解过程中,Ca2+、Mg2+在 (填“a”或“b”)极附近形成沉淀.
(1)某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如图1所示.

①酸洗时,为使水垢尽可能溶解,不宜选用的是
A.稀硫酸 B.盐酸 C.硝酸 D.醋酸
②不溶物用碳酸钠溶液浸泡时,反应的离子方程式是
③洗出液中的Fe3+会腐蚀铁质管道,反应的离子方程式是
④柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图2所示.图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是
(2)利用下图所示装置对锅炉水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止锅炉水垢的形成. 电解过程中,Ca2+、Mg2+在

考点:难溶电解质的溶解平衡及沉淀转化的本质,电解原理
专题:离子反应专题,电离平衡与溶液的pH专题
分析:(1)①稀硫酸会生成微溶物硫酸钙,会沉在反应物的表面,据此解答;
②沉淀物有向更难溶物转化的趋势,据此解答;
③依据反应原理写出离子反应方程式,依据氧化还原反应判断产物;
④依据平衡移动原理判断即可;依据题给信息判断含量最多的离子;
(2)依据电解水原理分析即可.
②沉淀物有向更难溶物转化的趋势,据此解答;
③依据反应原理写出离子反应方程式,依据氧化还原反应判断产物;
④依据平衡移动原理判断即可;依据题给信息判断含量最多的离子;
(2)依据电解水原理分析即可.
解答:
解:(1)①若使用稀硫酸会生成微溶物硫酸钙,会沉在反应物的表面,使反应物不能完全反应故不能选硫酸,故答案为:A;
②在水垢进行酸化之后,只有硫酸钙是不溶物,加入碳酸钠,可生成溶解度更小的碳酸钙,故答案为:CaSO4+CO32-?CaCO3+SO42-;
③Fe3+具有氧化性可以与具有还原性的铁反应生成亚铁离子,会腐蚀铁质管道.据得失电子总数相等的原则,两摩尔的三价铁离子,变成亚铁离子,总共得到两摩尔的电子,所以一摩尔Sn2+转化为Sn4+,故答案为:Fe+2Fe3+=3Fe2+;Sn4+;
④H3R?H2R-+H随着PH值的增大,氢离子浓度会减小,平衡向右移动,所以H3R含量会减少.H3R、H2R-、HR2-、R3-在图形中表示的曲线分别为a、b、c、d所以从图形上看,B点式最高的所以含量最多的是H2R-,故答案为:随溶液PH增大,平衡H3R?H2R-+H+向右移动所以,H3R的百分含量减小;H2R-;
(2)电解锅炉水实际上就是电解水,水电离出的氢离子在阴极放电,故阴极附近氢氧根浓度偏大,与锅炉水中的钙镁离子生成沉淀,与电源负极相连的极是阴极,即b极附近生成沉淀,故答案为:b.
②在水垢进行酸化之后,只有硫酸钙是不溶物,加入碳酸钠,可生成溶解度更小的碳酸钙,故答案为:CaSO4+CO32-?CaCO3+SO42-;
③Fe3+具有氧化性可以与具有还原性的铁反应生成亚铁离子,会腐蚀铁质管道.据得失电子总数相等的原则,两摩尔的三价铁离子,变成亚铁离子,总共得到两摩尔的电子,所以一摩尔Sn2+转化为Sn4+,故答案为:Fe+2Fe3+=3Fe2+;Sn4+;
④H3R?H2R-+H随着PH值的增大,氢离子浓度会减小,平衡向右移动,所以H3R含量会减少.H3R、H2R-、HR2-、R3-在图形中表示的曲线分别为a、b、c、d所以从图形上看,B点式最高的所以含量最多的是H2R-,故答案为:随溶液PH增大,平衡H3R?H2R-+H+向右移动所以,H3R的百分含量减小;H2R-;
(2)电解锅炉水实际上就是电解水,水电离出的氢离子在阴极放电,故阴极附近氢氧根浓度偏大,与锅炉水中的钙镁离子生成沉淀,与电源负极相连的极是阴极,即b极附近生成沉淀,故答案为:b.
点评:本题主要考查的是离子反应方程式的书写、氧化还原反应原理的利用,属于常考题.

练习册系列答案
相关题目
下列说法正确的是( )
| A、工业用电解熔融AlCl3的方法制金属铝 |
| B、铅蓄电池工作时,正极反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O |
| C、电解饱和食盐水时,用铁作阳极,Cl- 发生氧化反应 |
| D、电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)═N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是( )
A、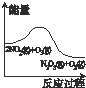 升高温度,NO2的含量减小 |
B、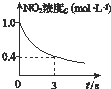 0~3 s内,反应速率为v(NO2)=0.2 mol?L-1 |
C、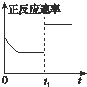 t1时仅加入催化剂,平衡正向移动 |
D、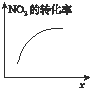 达平衡时,仅改变x,则x可能为压强 |
如图分子的一氯代物有几种( )


| A、9 | B、10 | C、11 | D、12 |
富勒烯是由60个碳原子构成的分子,碳原子成键情况与苯分子相似,由于它形似足球,所以又称足球烯.关于足球烯分子的叙述不正确的是( )
| A、一个分子中有12个五边形、20个六边形 |
| B、按凯库勒价键理论计算,12克足球烯可形成共价键的数目(共用电子对数)为1.5NA个 |
| C、按碳元素的四价理论计算,一个分子中有30个碳碳双键、60个碳碳单键 |
| D、N60分子与足球烯分子相似,每个氮原子的最外层电子数都满足8电子稳定结构 |