��Ŀ����
ij��ѧС��ģ�⡰�����Ƽ������NaCl��NH3��CO2��ˮ��Ϊԭ���Լ���1ͼ��ʾװ����ȡNaHCO3����Ӧ�Ļ�ѧ����ʽΪ��NH3+CO2+H2O+NaCl=NaHCO3+NH4Cl��Ȼ���ٽ�NaHCO3�Ƴ�Na2CO3��
��1��װ���ҵ������� ��Ϊ��ֹ��Ⱦ������β���к��е� ��Ҫ�������մ�����
��2����װ�ñ��в�����NaHCO3��ȡNa2CO3ʱ����Ҫ���е�ʵ������� ��ϴ�ӡ����գ�NaHCO3ת��ΪNa2CO3�Ļ�ѧ����ʽΪ ��
��3�����ڣ�2�������յ�ʱ��϶̣�NaHCO3���ֽⲻ��ȫ����С���һ�ݼ�����t1min��NaHCO3��Ʒ����ɽ���������̽����
ȡ������t1min��NaHCO3��Ʒ29.6g ��ȫ����ˮ�Ƴ���Һ��Ȼ�������Һ�л����صμ�ϡ���ᣬ�����Ͻ��裮��������ļ��룬��Һ���й����ӵ����ʵ����ı仯��2ͼ��ʾ��
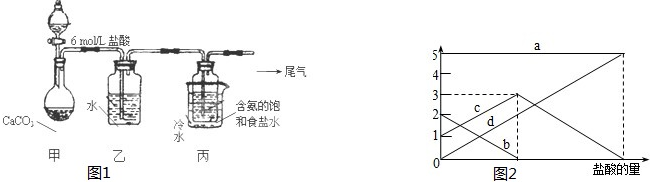
������c ��Ӧ����Һ�е������� �������ӷ��ţ�������Ʒ��NaHCO3��Na2CO3�����ʵ���֮���� ��
��4����ȡ21.0g NaHCO3���壬������t1min��ʣ����������Ϊ14.8g������Ѵ�ʣ�����ȫ�����뵽200mL 2mol/L�������У����ַ�Ӧ����Һ��H+�����ʵ���Ũ��Ϊ ������Һ����仯���Բ��ƣ���
��1��װ���ҵ�������
��2����װ�ñ��в�����NaHCO3��ȡNa2CO3ʱ����Ҫ���е�ʵ�������
��3�����ڣ�2�������յ�ʱ��϶̣�NaHCO3���ֽⲻ��ȫ����С���һ�ݼ�����t1min��NaHCO3��Ʒ����ɽ���������̽����
ȡ������t1min��NaHCO3��Ʒ29.6g ��ȫ����ˮ�Ƴ���Һ��Ȼ�������Һ�л����صμ�ϡ���ᣬ�����Ͻ��裮��������ļ��룬��Һ���й����ӵ����ʵ����ı仯��2ͼ��ʾ��

������c ��Ӧ����Һ�е�������
��4����ȡ21.0g NaHCO3���壬������t1min��ʣ����������Ϊ14.8g������Ѵ�ʣ�����ȫ�����뵽200mL 2mol/L�������У����ַ�Ӧ����Һ��H+�����ʵ���Ũ��Ϊ
���㣺���ҵ�������Ƽ��
ר�⣺������Ҫ�Ľ������仯����
��������1��װ�ü����Ʊ�������̼�������к����Ȼ�������Ժ���ʵ��������ţ���Ҫ��ȥ��β���к��а����������ŵ������У���Ҫ���գ�
��2��װ�ñ����ǰ����ı���ʳ��ˮ��ͨ�������̼����̼�����ƾ��壬ͨ�����˵õ�����ϴ�����յõ�̼���ƣ�NaHCO3ת��ΪNa2CO3�ķ����ǹ�����ȷֽ⣻
��3���������̼���ƺ�̼�����ƣ��������ᷢ����ӦCO32-+H+=HCO3-�� HCO3-+H+=CO2��+H2O������ͼ�����̼������Ӽ�С��̼������������ࣻ
��4�����ݷ�Ӧǰ�������仯��̼�����Ʒֽ��ԭ�����ݷ�Ӧǰ�������仯���㷴Ӧ��̼�����ƺ����ɵ�̼���ƣ����������������ʣ��̼�����ƣ�����õ�����ﷴӦ���ĵ������ӵõ���
��2��װ�ñ����ǰ����ı���ʳ��ˮ��ͨ�������̼����̼�����ƾ��壬ͨ�����˵õ�����ϴ�����յõ�̼���ƣ�NaHCO3ת��ΪNa2CO3�ķ����ǹ�����ȷֽ⣻
��3���������̼���ƺ�̼�����ƣ��������ᷢ����ӦCO32-+H+=HCO3-�� HCO3-+H+=CO2��+H2O������ͼ�����̼������Ӽ�С��̼������������ࣻ
��4�����ݷ�Ӧǰ�������仯��̼�����Ʒֽ��ԭ�����ݷ�Ӧǰ�������仯���㷴Ӧ��̼�����ƺ����ɵ�̼���ƣ����������������ʣ��̼�����ƣ�����õ�����ﷴӦ���ĵ������ӵõ���
���
�⣺��1��װ�ü����Ʊ�������̼����ķ�Ӧװ�ã����ɵĶ�����̼�����к����Ȼ������壬���Ʊ�̼��������Ӱ�죬װ���ҵ������������Ȼ������壻����β���к��а��������ŷŵ������У���Ҫ����β�����գ�
�ʴ�Ϊ������HCl��NH3��
��2����װ�ñ��в�����NaHCO3�����ķ�ӦΪ��NH3+CO2+H2O+NaCl=NaHCO3��+NH4Cl����ȡNa2CO3ʱ��Ҫ���˵õ����壬ϴ�Ӻ�������յõ�̼���ƣ�̼���������ȷֽ����ɶ�����̼��̼���ơ�ˮ����ӦΪ��2NaHCO3
Na2CO3+H2O+CO2����
�ʴ�Ϊ�����ˣ�2NaHCO3
Na2CO3+H2O+CO2����
��3�����ڣ�2�������յ�ʱ��϶̣�NaHCO3���ֽⲻ��ȫ����С���һ�ݼ�����t1min��NaHCO3��Ʒ����ɽ������о���ȡ������t1min��NaHCO3��Ʒ29.6g ��ȫ����ˮ�Ƴ���Һ��Ȼ�������Һ�л����صμ�ϡ���ᣬ�����Ͻ��裮��������ļ��룬������Ӧ CO32-+H+=HCO3-�� HCO3-+H+=CO2��+H2O����Һ���й����ӵ����ʵ����ı仯Ϊ̼������Ӽ�С��̼���������Ũ������̼�������ȫ��ת��Ϊ̼��������ӣ��ٵ��������̼��������ӷ�Ӧ���ɶ�����̼��̼��������Ӽ�С������c���߱�ʾ����̼���������Ũ�ȱ仯��̼�������Ũ��0.2mol/L��̼���������Ũ��Ϊ0.1mol/L����Ʒ��NaHCO3��Na2CO3�����ʵ���֮����1��2��
�ʴ�Ϊ��HCO3-�� 1��2��
��4����ȡ21g NaHCO3�������ʵ���=
=0.25mol��������t1min��ʣ����������Ϊ14.8g�����ݻ�ѧ����ʽ���ڵ������仯���㣺
2NaHCO3=Na2CO3+CO2��+H2O��m
2 1 62
0.2mol 0.1mol 21g-14.8g
��Ӧ��NaHCO3���ʵ���=0.25mol-0.2mol=0.05mol��NaHCO3+HCl=NaCl+H2O+CO2���������Ȼ������ʵ���0.05mol��
Na2CO3���ʵ���=0.1mol��Na2CO3+2HCl=2NaCl+H2O+CO2���������Ȼ������ʵ���0.2mol��ʣ���Ȼ������ʵ���=0.200L��2mol/L-0.05mol-0.2mol=0.15mol��ʣ����Һ��c��H+��=
=0.75mol/L��
�ʴ�Ϊ��0.75mol/L��
�ʴ�Ϊ������HCl��NH3��
��2����װ�ñ��в�����NaHCO3�����ķ�ӦΪ��NH3+CO2+H2O+NaCl=NaHCO3��+NH4Cl����ȡNa2CO3ʱ��Ҫ���˵õ����壬ϴ�Ӻ�������յõ�̼���ƣ�̼���������ȷֽ����ɶ�����̼��̼���ơ�ˮ����ӦΪ��2NaHCO3
| ||
�ʴ�Ϊ�����ˣ�2NaHCO3
| ||
��3�����ڣ�2�������յ�ʱ��϶̣�NaHCO3���ֽⲻ��ȫ����С���һ�ݼ�����t1min��NaHCO3��Ʒ����ɽ������о���ȡ������t1min��NaHCO3��Ʒ29.6g ��ȫ����ˮ�Ƴ���Һ��Ȼ�������Һ�л����صμ�ϡ���ᣬ�����Ͻ��裮��������ļ��룬������Ӧ CO32-+H+=HCO3-�� HCO3-+H+=CO2��+H2O����Һ���й����ӵ����ʵ����ı仯Ϊ̼������Ӽ�С��̼���������Ũ������̼�������ȫ��ת��Ϊ̼��������ӣ��ٵ��������̼��������ӷ�Ӧ���ɶ�����̼��̼��������Ӽ�С������c���߱�ʾ����̼���������Ũ�ȱ仯��̼�������Ũ��0.2mol/L��̼���������Ũ��Ϊ0.1mol/L����Ʒ��NaHCO3��Na2CO3�����ʵ���֮����1��2��
�ʴ�Ϊ��HCO3-�� 1��2��
��4����ȡ21g NaHCO3�������ʵ���=
| 21g |
| 84g/mol |
2NaHCO3=Na2CO3+CO2��+H2O��m
2 1 62
0.2mol 0.1mol 21g-14.8g
��Ӧ��NaHCO3���ʵ���=0.25mol-0.2mol=0.05mol��NaHCO3+HCl=NaCl+H2O+CO2���������Ȼ������ʵ���0.05mol��
Na2CO3���ʵ���=0.1mol��Na2CO3+2HCl=2NaCl+H2O+CO2���������Ȼ������ʵ���0.2mol��ʣ���Ȼ������ʵ���=0.200L��2mol/L-0.05mol-0.2mol=0.15mol��ʣ����Һ��c��H+��=
| 0.15mol |
| 0.2L |
�ʴ�Ϊ��0.75mol/L��
���������⿼���� ��ҵ�ƴ����ԭ�����������������е����ʱ仯�������ɷֵķ����жϺͼ���Ӧ�ã�ʵ����̷��������Ӳ�����β�����գ�ͼ���������жϣ���Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
��֪4������������ˮ�к�Һ���е��ܽ�ȣ�g/100g�ܼ���Ϊ��
�ɴ��ܽ�ȿ�֪��ˮ��Һ����������������ֽⷴӦΪ��2AgNO3+BaCl2=2AgCl��+Ba��NO3��2����ô�������ֻ�������Һ����Һ�з������ֽⷴӦ�Ļ�ѧ����ʽ��������
| ���� | AgNO3 | Ba��OH��2 | AgCl | BaCl2 |
| ˮ�� | 216 | 9.02 | 35.8 | |
| Һ�� | 86 | 97.2 | 0.8 | 0 |
| A��2AgNO3+BaCl2=2AgCl��+Ba��NO3��2 |
| B��2AgNO3+BaCl2=2AgCl+Ba��NO3��2�� |
| C��2AgCl+Ba��NO3��2=2AgNO3��+BaCl2 |
| D��2AgCl+Ba��NO3��2=2AgNO3+BaCl2�� |
��֪��Na2S2O3+H2SO4=S��+SO2+H2O+Na2SO4��ijͬѧͨ����ͬ�¶ȣ�������Ŀ��������о��¶ȶԷ�Ӧ���ʵ�Ӱ�죮��ѧ�����õ��о������ǣ�������
�ټ�˵��
��ʵ�鷨
�۷��෨
�ܱȽϷ���
�ټ�˵��
��ʵ�鷨
�۷��෨
�ܱȽϷ���
| A���١��� | B���١��� |
| C���ڡ��� | D���ڡ��� |
���й���Na2O��Na2O2��˵���У�����ȷ���ǣ�������
| A��Na2O2����Ư���� |
| B������ˮ��Ӧ����NaOH��������Ǽ��������� |
| C��Na2O����-2�ۣ�Na2O2����-1�� |
| D��������H2O��CO2��Ӧ |
���и��������ܴ�����������Һ��ɫΪ��ɫ���ǣ�������
| A��Na+��MnO4-��K+��NO3-��SO32- |
| B��Na+��CO32-��Cl-��Al3+��NO3- |
| C��Na+��S2-��OH-��K+��Cl-��NO3- |
| D��Fe2+��H+��Na+��Ca2+��NO3- |
 ��֪��������屽�������������±���ʾ
��֪��������屽�������������±���ʾ ijͬѧ�������ͼ��ʾ��װ�ã��г�װ������ȥ������̽��Ӱ�컯ѧ��Ӧ���ʵ����أ�
ijͬѧ�������ͼ��ʾ��װ�ã��г�װ������ȥ������̽��Ӱ�컯ѧ��Ӧ���ʵ����أ�