题目内容
等物质的量的SO2和SO3相比较,下列结论错误的是( )
| A、分子数之比为1:1 |
| B、所含原子数之比为2:3 |
| C、质量之比为1:1 |
| D、氧原子数之比为2:3 |
考点:物质的量的相关计算
专题:计算题
分析:结合化学式根据N=NA计算原子数目;根据m=nM计算质量,以此解答该题.
解答:
解:A.等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,故A正确;
B.等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,1个SO2分子中含有3个原子,1个SO3分子中含有4个原子,则原子总数之比为(1×3):(1×4)=3:4,故B错误;
C.等物质的量的SO2和SO3质量之比等于物质的摩尔质量之比=64:80=4:5,故C错误;
D.等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,1个SO2分子中含有2个氧原子,1个SO3分子中含有3个氧原子,则所含O原子数之比为(1×2):(1×3)=2:3,故D正确.
故选BC.
B.等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,1个SO2分子中含有3个原子,1个SO3分子中含有4个原子,则原子总数之比为(1×3):(1×4)=3:4,故B错误;
C.等物质的量的SO2和SO3质量之比等于物质的摩尔质量之比=64:80=4:5,故C错误;
D.等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,1个SO2分子中含有2个氧原子,1个SO3分子中含有3个氧原子,则所含O原子数之比为(1×2):(1×3)=2:3,故D正确.
故选BC.
点评:本题考查有关物质的量的计算,侧重于学生的分析能力和计算能力的考查,比较基础,注意根据分子式确定分子与原子物质的量关系.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目
已知下列两个反应中:4P(白磷,s)+5O2(g)=2P2O5(s)△H=-Q1 KJ/mol4P(红磷,s)+5O2(g)=2P2O5(s)△H=-Q2 KJ/mol且Q1>Q2,则( )
| A、燃烧白磷放出的能量比燃烧红磷放出的能量多 |
| B、白磷转化为红磷是属于放热反应 |
| C、白磷和红磷互为同素异形体 |
| D、等质量的白磷和红磷,白磷含有的能量比红磷的低 |
下列物质性质的比较中,正确的是( )
| A、原子半径:C>N>O |
| B、熔点:SiO2>CO2>H2O |
| C、热稳定性:NaHCO3>Na2CO3>H2CO3 |
| D、氧化性:Na+>Mg2+>Al3+ |
下列说法正确的是( )
| A、工业用电解熔融AlCl3的方法制金属铝 |
| B、铅蓄电池工作时,正极反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O |
| C、电解饱和食盐水时,用铁作阳极,Cl- 发生氧化反应 |
| D、电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
关于2mol二氧化碳的下列叙述中,正确的是( )
| A、含有2molO2 |
| B、体积为44.8L |
| C、分子数约为6.02×1023个 |
| D、质量为88g |
 如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成500mL溶液,请计算
如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容.某同学从该试剂瓶中取出24.0g固体,配成500mL溶液,请计算
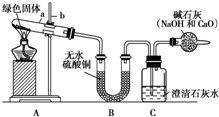 西安北郊古墓中曾出土一青铜锤(一种酒具),表面附着有绿色固体物质,打开盖子酒香扑鼻,内盛有26kg青绿色液体,专家认定是2000多年前的“西汉美酒”.这是我国考古界、酿酒界的一个重大发现.
西安北郊古墓中曾出土一青铜锤(一种酒具),表面附着有绿色固体物质,打开盖子酒香扑鼻,内盛有26kg青绿色液体,专家认定是2000多年前的“西汉美酒”.这是我国考古界、酿酒界的一个重大发现.