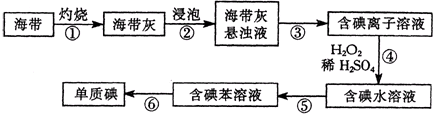
题目内容
下表对某些反应方程式的评价合理的是( )
| 编号 | 叙述 | 离子方程式 | 评价 |
| A | NaHCO3溶液中滴加少量的Ba(OH)2溶液 | Ba2++OH-+HCO3-=BaCO3↓+H2O | 正确 |
| B | 向NaOH溶液中滴加过量Ca(HCO3)2溶液 | OH-+HCO3-+Ca2+=CaCO3↓+H2O | 错误,Ca(HCO3)2溶液中阴阳离子比2:1 |
| C | 足量的Ba(HCO3)2溶液与NaHSO4溶液混合 | H++SO42-+Ba2++HCO3-=BaSO4↓+CO2↑+H2O | 正确 |
| D | 向KHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性 | Ba2++OH-+SO42-+H+=BaSO4↓+H2O | 正确 |
| A、A | B、B | C、C | D、D |
考点:离子方程式的书写
专题:离子反应专题
分析:A.NaHCO3溶液中滴加少量的Ba(OH)2溶液,反应生成碳酸钡、碳酸钠和水;
B.向NaOH溶液中滴加过量Ca(HCO3)2溶液,反应生成碳酸钙、碳酸氢钠和水;
C.足量的Ba(HCO3)2溶液与NaHSO4溶液混合,反应生成硫酸钡、碳酸氢钠、水和二氧化碳;
D.离子个数不符合物质的配比.
B.向NaOH溶液中滴加过量Ca(HCO3)2溶液,反应生成碳酸钙、碳酸氢钠和水;
C.足量的Ba(HCO3)2溶液与NaHSO4溶液混合,反应生成硫酸钡、碳酸氢钠、水和二氧化碳;
D.离子个数不符合物质的配比.
解答:
解:A.NaHCO3溶液中滴加少量的Ba(OH)2溶液,反应生成碳酸钡、碳酸钠和水,离子方程式为:Ba2++2OH-+2HCO3-=BaCO3↓+H2O+CO32-,故A错误;
B.向NaOH溶液中滴加过量Ca(HCO3)2溶液,离子方程式为:OH-+HCO3-+Ca2+=CaCO3↓+H2O,B选项评价错误,故B错误;
C.足量的Ba(HCO3)2溶液与NaHSO4溶液混合,离子方程式为:H++SO42-+Ba2++HCO3-=BaSO4↓+CO2↑+H2O,故C正确;
D.向KHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性,离子方程式为:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O,故D错误;
故选:C.
B.向NaOH溶液中滴加过量Ca(HCO3)2溶液,离子方程式为:OH-+HCO3-+Ca2+=CaCO3↓+H2O,B选项评价错误,故B错误;
C.足量的Ba(HCO3)2溶液与NaHSO4溶液混合,离子方程式为:H++SO42-+Ba2++HCO3-=BaSO4↓+CO2↑+H2O,故C正确;
D.向KHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性,离子方程式为:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O,故D错误;
故选:C.
点评:本题考查了离子方程式的书写,明确反应的实质是解题关键,注意反应物用量对反应的影响,题目难度中等.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
如图分子的一氯代物有几种( )


| A、9 | B、10 | C、11 | D、12 |
为了证明硫酸亚铁铵[(NH4)2Fe(SO4)26H2O]晶体的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是( )
| A、取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B、取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+ |
| C、取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D、取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+ |
富勒烯是由60个碳原子构成的分子,碳原子成键情况与苯分子相似,由于它形似足球,所以又称足球烯.关于足球烯分子的叙述不正确的是( )
| A、一个分子中有12个五边形、20个六边形 |
| B、按凯库勒价键理论计算,12克足球烯可形成共价键的数目(共用电子对数)为1.5NA个 |
| C、按碳元素的四价理论计算,一个分子中有30个碳碳双键、60个碳碳单键 |
| D、N60分子与足球烯分子相似,每个氮原子的最外层电子数都满足8电子稳定结构 |

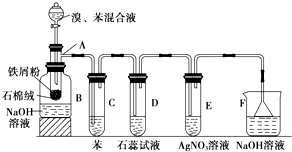 已知苯、溴和溴苯的物理性质如下表所示
已知苯、溴和溴苯的物理性质如下表所示