题目内容
(1)有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,NaA溶液呈中性,1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC用样的装置分别作导电性试验,发现后者的灯泡比前者亮,则这四种酸的酸性由强到弱的顺序为
(2)已知难溶电解质溶解平衡时M(OH)2(s)?M2+(aq)+2OH-(aq),溶液的pH=a,则其Ksp=
(3)溶液的酸度表示为AG=lg[
],又知100℃时,水的离子积常数为1×10-12,25℃时纯水的AG1和100℃时食盐水的AG2的关系为:AG1 AG2(=、<、>);在100℃时将V1ml AG=8的硫酸与V2ml AG=-6的烧碱溶液混合后AG=0,则V1:V2= .
(2)已知难溶电解质溶解平衡时M(OH)2(s)?M2+(aq)+2OH-(aq),溶液的pH=a,则其Ksp=
(3)溶液的酸度表示为AG=lg[
| C(H+) |
| C(OH-) |
考点:难溶电解质的溶解平衡及沉淀转化的本质,电解质溶液的导电性
专题:电离平衡与溶液的pH专题
分析:(1)酸的酸性越强,酸根离子水解程度越小,相同浓度的钠盐溶液,酸根离子水解程度越大其钠盐溶液pH越大;
强酸强碱盐溶液呈中性,强碱弱酸盐溶液呈碱性;溶液导电能力与溶液中离子浓度成正比,据此判断四种酸的酸性强弱;
(2)依据pH表示出c(H+),然后计算出c(OH-),依据溶解平衡方程式计算溶度积即可;
(3)中性溶液中,氢离子浓度等于氢氧根离子浓度,在25℃时,KW=C(H+)×C(OH-)=10-14,C(H+)=C(OH-)=1×10-7mol?L-1;100℃时,水的离子积常数为1×10-12,100℃时食盐水呈中性,C(H+)=C(OH-)=1×10-6,根据AG=lg[c(H+)/c(OH-)],则有AG=lgc(H+)-lgc(OH-)=lgc(H+)-lg
=14+2lgc(H+)=14-2pH,根据AG与PH的关系进行分析.
强酸强碱盐溶液呈中性,强碱弱酸盐溶液呈碱性;溶液导电能力与溶液中离子浓度成正比,据此判断四种酸的酸性强弱;
(2)依据pH表示出c(H+),然后计算出c(OH-),依据溶解平衡方程式计算溶度积即可;
(3)中性溶液中,氢离子浓度等于氢氧根离子浓度,在25℃时,KW=C(H+)×C(OH-)=10-14,C(H+)=C(OH-)=1×10-7mol?L-1;100℃时,水的离子积常数为1×10-12,100℃时食盐水呈中性,C(H+)=C(OH-)=1×10-6,根据AG=lg[c(H+)/c(OH-)],则有AG=lgc(H+)-lgc(OH-)=lgc(H+)-lg
| 10-14 |
| c(H+) |
解答:
解:(1)酸的酸性越强,酸根离子水解程度越小,相同浓度的钠盐溶液,酸根离子水解程度越大其钠盐溶液pH越大,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,说明酸性强弱:HB>HD;强酸强碱盐溶液呈中性,强碱弱酸盐溶液呈碱性,NaA溶液呈中性,说明HA为强酸,1mol/L的KC溶液遇酚酞试液呈红色,该溶液呈碱性,说明HC为弱酸;溶液导电能力与溶液中离子浓度成正比,同体积、同物质的量浓度的HB、HC用样的装置分别作导电性试验,发现后者的灯泡比前者亮,说明HC溶液中离子浓度大于HB,且二者浓度相等,所以酸性:HC>HB,通过以上分析知,这四种酸强弱顺序是HA>HC>HB>HD,故答案为:HA>HC>HB>HD;
(2)溶液的pH=a,c(H+)=10-a,故c(OH-)=
=
=10a-14,依据M(OH)2(s)?M2+(aq)+2OH-(aq),得c(M2+)=
c(OH-)=
×10 a-14,故Ksp=c(M2+)c2(OH-)
×10a-14×(10a-14)2=
×103a-42,故答案为:
;
(3)在25℃时,纯水呈中性,C(H+)=C(OH-)=1×10-7mol?L-1,pH=-lgC(H+)=lg(10-7)=7,AG=lg[
]=lg1=0,100℃时食盐水呈中性,C(H+)=C(OH-)=1×10-6,AG=lg[
]=lg1=0,所以AG1=AG2,
100℃时,水的离子积常数为1×10-12,C(H+)=C(OH-)=1×10-6,PH=6呈中性,在100℃时将V1ml AG=8的硫酸则有AG=14-2pH=8,pH=3,AG=-6的烧碱溶液AG=14-2pH=-6,PH=10,混合后AG=0,AG=14-2pH=0,pH=7>6呈碱性,即
=
,V1:V2≈1:10,
故答案为:=;1:10.
(2)溶液的pH=a,c(H+)=10-a,故c(OH-)=
| Kw |
| c(H+) |
| 10-14 |
| 10-a |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 103a-42 |
| 2 |
(3)在25℃时,纯水呈中性,C(H+)=C(OH-)=1×10-7mol?L-1,pH=-lgC(H+)=lg(10-7)=7,AG=lg[
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |
100℃时,水的离子积常数为1×10-12,C(H+)=C(OH-)=1×10-6,PH=6呈中性,在100℃时将V1ml AG=8的硫酸则有AG=14-2pH=8,pH=3,AG=-6的烧碱溶液AG=14-2pH=-6,PH=10,混合后AG=0,AG=14-2pH=0,pH=7>6呈碱性,即
| ||
| V1+V2 |
| 10-12 |
| 10-7 |
故答案为:=;1:10.
点评:本题考查酸性强弱判断、AG的计算,明确酸的酸性强弱与酸根离子水解程度的关系是解本题关键,注意:溶液导电能力与离子浓度成正比,与电解质强弱无关,但如果相同元数、相同浓度的酸或碱溶液,可以根据溶液导电性强弱判断电解质强弱,为易错点.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
关于2mol二氧化碳的下列叙述中,正确的是( )
| A、含有2molO2 |
| B、体积为44.8L |
| C、分子数约为6.02×1023个 |
| D、质量为88g |
为了证明硫酸亚铁铵[(NH4)2Fe(SO4)26H2O]晶体的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是( )
| A、取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B、取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+ |
| C、取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D、取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+ |
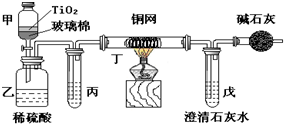 未来生活中金属钛的运用越来越广泛,如可在催化剂TiO2作用下,先用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题:
未来生活中金属钛的运用越来越广泛,如可在催化剂TiO2作用下,先用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题: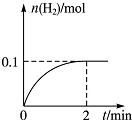 化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题: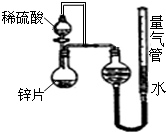 某同学设计了如图所示的装置(夹持装置已略去),来探究影响化学反应速率的因素.
某同学设计了如图所示的装置(夹持装置已略去),来探究影响化学反应速率的因素.