题目内容
2.下列说法正确的是(NA表示阿伏加德罗常数)( )| A. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| B. | 1 molFe与足量的Cl2反应转移的电子数为2NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 标准状况下,22.4 LSO3含有的原子数为4NA |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、铁与氯气反应后变为+3价;
C、氧气和臭氧均由氧原子构成;
D、标况下三氧化硫为固体.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氯气的物质的量小于0.5mol,则含有的分子个数小于0.5NA个,故A错误;
B、铁与氯气反应后变为+3价,故1mol铁转移3mol电子即3NA个,故B错误;
C、氧气和臭氧均由氧原子构成,故32g混合物中含有的氧原子的物质的量为n=$\frac{32g}{16g/mol}$=2mol,故含有2NA个,故C正确;
D、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和原子个数,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
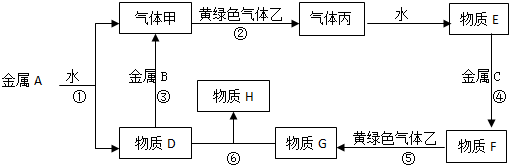
12.如图所示,6个编号分别代表下列物质中的一种物质,凡是直线相连的两种物质均能发生化学反应(已知高温下氨气能还原氧化铁).图中⑤表示的物质是( )
a.Al b.Fe2O3 c.NaOH 溶液 d.Cl2 e.NH3 f.氢碘酸溶液.
a.Al b.Fe2O3 c.NaOH 溶液 d.Cl2 e.NH3 f.氢碘酸溶液.

| A. | a 或b | B. | c | C. | d 或e | D. | f |
13.下列物质性质与应用对应关系错误的是( )
| A. | 氧化镁的熔点高,可用作耐火材料 | |
| B. | 碳酸钠具有弱碱性,可用作胃酸中和剂 | |
| C. | 二氧化硫具有漂白性,可用作漂白纸浆 | |
| D. | 氯化铁溶液能腐蚀铜,可用于制作印刷电路板 |
10.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 7.8g苯中碳碳双键的数目为0.3NA | |
| B. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-的个数为NA | |
| C. | 常温常压,11.2L NO和O2混合气体的原子数为NA | |
| D. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数为0.46NA |
17.某实验小组分析m1g由Al、Cu、Al2O3、Fe3O4组成的混合物粉末A成分,方案如下:
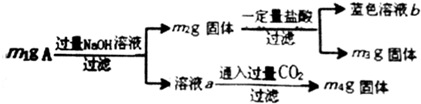
下列分析错误的是( )

下列分析错误的是( )
| A. | 由m1、m2、m4可计算出混合物中Al、Al2O3的物质的量 | |
| B. | 生成蓝色溶液的离子方程式为Cu+2Fe3+=Cu2++2Fe2+ | |
| C. | 蓝色溶液中一定有Cu2+、Fe2+、Fe3+ | |
| D. | 当m2-m3=2.96g时,Fe3O4的质量至少为2.32g |
11.下列反应中,属于放热反应的是( )
| A. | 铝粉与氧化铁的反应 | B. | 氯化铵晶体与Ba(OH)2•8H2O的反应 | ||
| C. | 氯酸钾的分解反应 | D. | 盐类的水解反应 |
12.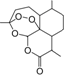 我国女科学家屠呦呦的名字出自《诗经•小雅》:“呦呦鹿鸣,食野之蒿.我有嘉宾,德音孔昭”,她因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖.下列有关青蒿素的叙述错误的是( )
我国女科学家屠呦呦的名字出自《诗经•小雅》:“呦呦鹿鸣,食野之蒿.我有嘉宾,德音孔昭”,她因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖.下列有关青蒿素的叙述错误的是( )
 我国女科学家屠呦呦的名字出自《诗经•小雅》:“呦呦鹿鸣,食野之蒿.我有嘉宾,德音孔昭”,她因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖.下列有关青蒿素的叙述错误的是( )
我国女科学家屠呦呦的名字出自《诗经•小雅》:“呦呦鹿鸣,食野之蒿.我有嘉宾,德音孔昭”,她因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖.下列有关青蒿素的叙述错误的是( )| A. | 分子式为C15H20O5 | B. | 易溶于C2H5OC2H5 | ||
| C. | 官能团有醚键和酯基 | D. | 能与NaOH溶液反应 |