题目内容
13.下列物质性质与应用对应关系错误的是( )| A. | 氧化镁的熔点高,可用作耐火材料 | |
| B. | 碳酸钠具有弱碱性,可用作胃酸中和剂 | |
| C. | 二氧化硫具有漂白性,可用作漂白纸浆 | |
| D. | 氯化铁溶液能腐蚀铜,可用于制作印刷电路板 |
分析 A、氧化镁和氧化铝熔点较高;
B、小苏打为碳酸氢钠,能够中和胃酸中的盐酸;
C、二氧化硫具有漂白性;
D、氯化铁溶液与铜反应生成氯化亚铁和氯化铜.
解答 解:A、氧化镁和氧化铝熔点较高,可用作高温耐火材料,故A正确;
B、小苏打能够与胃酸中的盐酸反应,能够作胃酸的中和剂,而不碳酸钠,故B错误;
C、二氧化硫具有漂白性,可以漂白纸浆,故C正确;
D、氯化铁溶液与铜反应生成氯化亚铁和氯化铜,可用于制作印刷电路板,故D正确;
故选B.
点评 本题考查知识点较多,涉及氧化镁的熔点高、二氧化硫的漂白、印刷电路板等知识,难度不大,注意物质的性质的应用是关键.

练习册系列答案
相关题目
3.NaCl是一种化工原料,可以制备一系列物质(如下图).下列说法正确的是( )
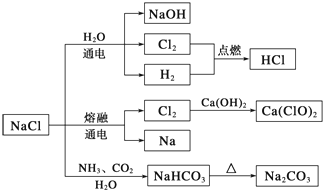

| A. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 电解NaCl溶液的阳极产物为H2和NaOH | |
| D. | 图中所示转化反应都是氧化还原反应 |
4.下列有关比较中正确的是( )
| A. | 第一电离能:P>S | B. | 气态氢化物的稳定性:CH4>NH3 | ||
| C. | 电负性:CI>F | D. | 最高正化合价:F>S |
1.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 医学上,血液透析是利用了胶体的渗析原理 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 二氧化硅是人类将太阳能转换为电能的常用材料 |
18.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y和W同主族,Z+与Y2-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | X的最高价氧化物对应水化物的酸性比W的弱 | |
| C. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| D. | W的气态简单氢化物的热稳定性比Y的强 |
2.下列说法正确的是(NA表示阿伏加德罗常数)( )
| A. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| B. | 1 molFe与足量的Cl2反应转移的电子数为2NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 标准状况下,22.4 LSO3含有的原子数为4NA |
3.重铬酸钾(K2Cr2O7)是一种重要的无机试剂.
(1)①K2Cr2O7在加热条件下可以氧化浓盐酸产生氯气,其还原产物为Cr3+.该反应的离子方程式为Cr2O72-+14H++6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
②常温下,Fe2+可将Cr2O72-还原为Cr3+,利用此反应原理可处理废水中有毒的Cr2O72-.某废水中Cr2O72-的浓度为0.005 mol/L,若处理10 L该废水至少需要绿矾(FeSO4•7H2O)83.4g.
(2)K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+.
①若平衡体系的pH=2,则溶液显橙色.
②高温时,向饱和Na2Cr2O7溶液中先加入少量的硫酸,再加入一定量KCl固体,降温,就会析出K2Cr2O7晶体和NaCl晶体的混合物.加入少量硫酸的原因为H2SO4电离产生的H+使Cr2O72-+H2O?2CrO42-+2H+逆向移动,从而增大了c(Cr2O72-),提高K2Cr2O7产率;不同温度下,相关物质的溶解度数据如下表所示,请分析加入KCl固体后,降温会析出K2Cr2O7晶体的原因为K2Cr2O7的溶解度随温度降低减小的幅度大,使得复分解反应Na2Cr2O7+KCl=K2Cr2O7↓+NaCl得以发生,从而析出K2Cr2O7晶体.
③向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2,可析出BaCrO4和PbCrO4两种沉淀,此时溶液中$\frac{c(P{b}^{2+})}{c(B{a}^{2+})}$=2.3×10-3.[已知:Ksp(BaCrO4)=1.2×10-10;Ksp(PbCrO4)=2.8×10-13].
(1)①K2Cr2O7在加热条件下可以氧化浓盐酸产生氯气,其还原产物为Cr3+.该反应的离子方程式为Cr2O72-+14H++6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
②常温下,Fe2+可将Cr2O72-还原为Cr3+,利用此反应原理可处理废水中有毒的Cr2O72-.某废水中Cr2O72-的浓度为0.005 mol/L,若处理10 L该废水至少需要绿矾(FeSO4•7H2O)83.4g.
(2)K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+.
①若平衡体系的pH=2,则溶液显橙色.
②高温时,向饱和Na2Cr2O7溶液中先加入少量的硫酸,再加入一定量KCl固体,降温,就会析出K2Cr2O7晶体和NaCl晶体的混合物.加入少量硫酸的原因为H2SO4电离产生的H+使Cr2O72-+H2O?2CrO42-+2H+逆向移动,从而增大了c(Cr2O72-),提高K2Cr2O7产率;不同温度下,相关物质的溶解度数据如下表所示,请分析加入KCl固体后,降温会析出K2Cr2O7晶体的原因为K2Cr2O7的溶解度随温度降低减小的幅度大,使得复分解反应Na2Cr2O7+KCl=K2Cr2O7↓+NaCl得以发生,从而析出K2Cr2O7晶体.
 | 20℃ | 60℃ | 100℃ |
| Na2Cr2O7 | 73.2 | 82.0 | 91.4 |
| K2Cr2O7 | 13.1 | 50.5 | 96.2 |
| NaCl | 36 | 37 | 39 |
| KCl | 34 | 45.5 | 56.7 |
