题目内容
17.某实验小组分析m1g由Al、Cu、Al2O3、Fe3O4组成的混合物粉末A成分,方案如下: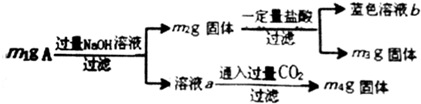
下列分析错误的是( )
| A. | 由m1、m2、m4可计算出混合物中Al、Al2O3的物质的量 | |
| B. | 生成蓝色溶液的离子方程式为Cu+2Fe3+=Cu2++2Fe2+ | |
| C. | 蓝色溶液中一定有Cu2+、Fe2+、Fe3+ | |
| D. | 当m2-m3=2.96g时,Fe3O4的质量至少为2.32g |
分析 A.由Al、Cu、Al2O3、Fe3O4组成的混合物粉末Al中加入过量的氢氧化钠溶液,铝和氧化铝溶解生成偏铝酸钠溶液,再通入二氧化碳得氢氧化铝质量为m4g,根据铝元素守恒可知原样品中铝元素的总物质的量,过滤得m2g固体中含有铜和四氧化三铁,所以原样品中铝和氧化铝的质量为m1g-m2g,据此可连列方程组求得铝和氧化铝的物质的量;
B.Fe3O4与盐酸反应生成氯化铁和氯化亚铁,三价铁离子有强氧化性;
C.如果样品中铜的含量较多,铜能将铁离子还原为亚铁离子,溶液中一定有铁离子;
D.引固体质量改变的金属氧化物的溶解,和三价铁与铜单质之间的氧化还原反应.
解答 解:A.由Al、Cu、Al2O3、Fe3O4组成的混合物粉末Al中加入过量的氢氧化钠溶液,铝和氧化铝溶解生成偏铝酸钠溶液,再通入二氧化碳得氢氧化铝质量为m4g,根据铝元素守恒可知原样品中铝元素的总物质的量,过滤得m2g固体中含有铜和四氧化三铁,所以原样品中铝和氧化铝的质量为m1g-m2g,据此可连列方程组求得铝和氧化铝的物质的量,故A正确;
B.Fe3O4与盐酸反应生成氯化铁和氯化亚铁,三价铁离子有强氧化性,发生Cu+2Fe3+═Cu2++2Fe2+,故B正确;
C.如果样品中铜的含量较多,铜能将铁离子还原为亚铁离子,溶液中一定有铁离子,故C错误;
D.固体质量改变的原因有:金属氧化物的溶解,三价铁与铜单质之间的氧化还原反应,Cu+2Fe3+=Cu2++2Fe2+,Fe3O4~2Fe3+~Cu,也就是四氧化三铁和铜的物质的量大于1:1,m2-m3=2.96g才符合,最小值为1:1,即2.96g×$\frac{232}{232+64}$×100%=2.32 g,故D正确;
故选C.
点评 本题考查常见金属元素及化合物的综合应用,题目难度中等,要通过实验现象得出结论,再结合定量计算得出结论,明确发生反应的实质为解答关键,试题培养了学生的分析能力及化学计算能力.

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案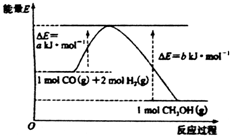
| A. | 该反应的活化能为a kJ•mol-1 | |
| B. | 1mol CO(g)和2 mol H2(g)的能量和大于1mol CH3OH(g)的能量 | |
| C. | 该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=(a-b)kJ•mol-1 | |
| D. | CO(g)+2H2(g)=CH3OH(1)△H=c kJ•mol-1c>(a-b) |
| A. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| B. | 1 molFe与足量的Cl2反应转移的电子数为2NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 标准状况下,22.4 LSO3含有的原子数为4NA |
| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA | |
| C. | 2 L 0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| D. | 1 mol Na2O2固体中含离子总数为4NA |
| A. | 焓变和熵变都与反应的自发性有关,又都不能独立地作为自发性的判据 | |
| B. | -10℃的液态水就会自动结冰成为固态,因为这是熵增的过程 | |
| C. | 大量事实告诉我们,过程的自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的速率 | |
| D. | 放热反应过程中体系能量降低,因此有自发进行的倾向,但是有些吸热反应也可以自发进行 |
①X+Ca(OH)2→Y+CaCO3↓
②W$\stackrel{△}{→}$X+CO2↑+H2O
③Z+CO2→X+O2
④Z+H2O→Y+O2↑
则X、Y、Z、W依次是( )
| A. | KCl、KOH、K2CO3、KHCO3 | B. | K2CO3、KOH、K2O2、KHCO3 | ||
| C. | K2SO3、KOH、K2O2、KHCO3 | D. | KHCO3、KOH、K2O2、K2CO3 |
